FDA関連ニュース
2023年02月22日
FDA、植物由来の代替ミルクのラベル表示に関するガイダンス案を公表
 FDAは、植物由来の代替ミルクの表示について、任意の栄養表示を推奨すること等を含む、名称とラベル表示に関する業界向けの勧告案を発表しました。 これにより、消費者が購入の際に栄養素に関する十分な情報が提供されているようになる事が期待されます。
FDAは、植物由来の代替ミルクの表示について、任意の栄養表示を推奨すること等を含む、名称とラベル表示に関する業界向けの勧告案を発表しました。 これにより、消費者が購入の際に栄養素に関する十分な情報が提供されているようになる事が期待されます。
市場で入手可能なさまざまなミルク代替製品の種類は、大豆、米、アーモンドだけでなく、カシュー、ココナッツ等をベースにした飲み物まで大きく拡大してきました。 これらの製品は、木の実、マメ科植物、種子、穀物などの植物材料の液体ベースの抽出物から作られていますが、ほとんどの場合「ミルク」という用語を含む名前でラベル付けされています。
当ガイダンス案「植物由来の代替ミルクおよび任意の栄養表示のラベル表示: 業界向けガイダンス」では、名称に「ミルク」という用語を含む植物由来の代替ミルク製品 (例: 「ソイミルク(豆乳)」または「アーモンドミルク」)、および牛乳とは異なる栄養組成を有するものには、米国農務省 (USDA) 食品栄養局の液体ミルク代替品栄養基準に基づいて、栄養学的にどのように異なるかを説明する栄養表示をつけることを推奨しています。 例えば、ラベルに「牛乳よりもビタミン D とカルシウムの含有量が少ない」と表示できます。
2018年9月、FDAが、植物由来の代替ミルク(PBMA-Plant-Based Milk Alternatives)の表示に関してコメントを求めたところ、13,000を超えるコメントが寄せられ、これにより消費者は一般的に PBMAに牛乳が含まれていないことを理解し、牛乳ではないという理由で PBMA を購入するという事が分かりました。しかし、多くの消費者は、牛乳と PBMA 製品の栄養上の違いを認識していないとみられます。例えば、アーモンドまたはオート麦ベースの PBMA 製品にはカルシウムが添加されており、カルシウム源として摂取される可能性がありますが、全体的な栄養成分は牛乳や栄養分強化大豆飲料とは異なり、食事ガイドライン 2020-2025においては乳製品グループの一部として含まれていません。
牛乳を含む乳製品は、健康的な食事パターンの一部として食事ガイドラインで推奨されており、タンパク質、ビタミン A および B-12、カルシウム、カリウム、ビタミンDなどの重要な栄養素を含みますが、これらの消費量は不足しています。食事ガイドラインでは、栄養成分が牛乳に似ているという理由で、栄養分強化大豆飲料のみが乳製品グループに含まれています。 ただし、PBMA 製品の栄養組成は種類によって大きく異なり、多くのPBMAには牛乳と同等の重要な栄養素は含まれていません。
「食品表示は消費者の行動をサポートする重要な方法であるため、消費者が十分な情報に基づいて購入判断できるように、任意の栄養表示を使用することをお勧めします。」とFDA食品安全応用栄養センター所長の Susan T. Mayne 博士は述べています。
ガイダンス案では、産業界が USDA の食品栄養局の液体ミルク代替品栄養基準を使用して、PBMA が栄養的に牛乳に類似しているかどうかを判断することを推奨しています。また、FDAは、消費者が栄養成分表示を使用してさまざまな製品の栄養成分を比較し、情報に基づいた選択を行うことを奨励しています。
FDAは、ガイダンス案に関するコメントを2023年4月24日まで受け付けています。今回発表されたガイダンス案は、植物ベースのミルクの表示のみに適用され、他の植物ベースの乳製品代替品(チーズやヨーグルトの代替品)には適用されません 。なお、FDAは、他の植物ベースの代替製品の表示と名称に対処するためのガイダンス案を作成中です。
2023年01月20日
2022年度のFDA検査違反トップ10
 米国食品医薬品局(FDA)は、2022年度の年次査察観察データを発表しました。このデータは、2021年10月から2022年9月の間に、FDAの食品施設査察で特定の違反がどのくらいの頻度で検出されたかを示しています。2022年度にFDA査察官が指摘した違反のトップ10は以下の表のとおりです。
米国食品医薬品局(FDA)は、2022年度の年次査察観察データを発表しました。このデータは、2021年10月から2022年9月の間に、FDAの食品施設査察で特定の違反がどのくらいの頻度で検出されたかを示しています。2022年度にFDA査察官が指摘した違反のトップ10は以下の表のとおりです。
| 連邦規則集 | 項目 | 概要 | 頻度 | |
|---|---|---|---|---|
| 1 | 21 CFR 1.502(a) | FSVP策定 | FSVPを策定していなかった。 ●輸入する各食品については一部の例外を除き、外国の供給業者が、第418条(特定の食品のハザード分析およびリスクに基づく予防管理に関する)または第419条(農産物の安全性の基準に関する)で要求されるものと少なくとも同レベルの公衆衛生の保護を提供するプロセスおよび手順を遵守して食品を製造していることを十分に保証するFSVPを策定し、維持し、遵守しなければならない。 |
727 |
| 2 | 21 CFR 117.35(c) | 有害生物防除(ペストコントロール) | 食品の汚染を防ぐために、[食品工場から害虫を排除][注意と制限のもとで殺虫剤を使用]しなかった。 |
171 |
| 3 | 21 CFR 117.35(a) | 衛生に係るオペレーション - 施設管理 | [工場を清潔で衛生的な状態に保つ][工場を修理しておく]ことをしなかった。 ●工場の建物、備品、その他の物理的施設は、清潔で衛生的な状態に維持されなければならず、また、食品の混入を防ぐのに十分な修理が行われなければならない。器具および機器の清掃および消毒は、アレルゲンの相互接触や、食品、食品接触面、または食品包装材の汚染を防ぐ方法で行わなければならない。 |
162 |
| 4 | 21 CFR 117.80(c) | 製造、加工、梱包、保管 - 管理 | [微生物の増殖] [アレルゲンの相互接触] [食品の汚染] [食品の劣化]の可能性を最小限に抑えるために必要な条件と管理の下で業務を実行しなかった。 |
155 |
| 5 | 21 CFR 117.10 | 人員 | 人事に関する合理的な措置や予防策を講じなかった。 ●施設の管理者は、疾病管理と清潔さを保証するために合理的な措置と予防措置を講じなければならない。 |
151 |
| 6 | 21 CFR 1.505(a)(2) | 評価 - 業績、リスク |
[外国供給業者の業績] [食品がもたらすリスク] を判断するために評価を実施したことを文書化していなかった。 | 129 |
| 7 | 21 CFR 1.506(b) | 供給業者の検証 - 書面による手順の確立 | 供給業者が、輸入する食品に関して適切な外国供給業者の検証活動が実施されることを確実にするための[適切な]書面による手順を確立していなかった。 | 127 |
| 8 | 21 CFR 117.40 | 設備・機器 - 設計とメンテナンス | 設備や器具が、[アレルゲンの相互接触][汚染]から保護するために、十分な洗浄やメンテナンスができるように設計・構築されていなかった。 |
115 |
| 9 | 21 CFR 1.504(b)(1) | ハザード分析 生物学的、化学的、物理的 |
実施したハザード分析に、管理を必要とする既知の、または合理的に予測可能な [生物学的] [化学的] [物理的] ハザードが含まれていなかった。 | 111 |
| 10 | 21 CFR 111.70(e) | 仕様 - アイデンティティ、純度、強度、組成 | 栄養補助食品の[アイデンティティ][純度][強度][組成]に関する製品仕様を確立していなかった。 | 103 |
| 10 | 21 CFR 117.20(b) | 工場建設と設計 | 工場が、メンテナンスや衛生的な運用を容易にするために[建設][設計]されていなかった。 ●工場は、食品生産目的(製造、加工、梱包、保持など)のためのメンテナンスや衛生的な作業を容易にするために、サイズ、構造、設計が適切でなければならない。 |
103 |
| 10 | 21 CFR 1.504(a) | ハザード分析の文書化 | [管理を必要とするハザードがあるかどうかを判断するため]、既知または合理的に予見可能なハザードを特定および評価するためのハザード分析を文書化していなかった。 ●施設で製造、加工、包装、保管される食品の種類ごとに、経験、疾病データ、科学的報告、その他の情報に基づいて、既知のまたは合理的に予見可能なハザードを特定・評価し、予防的管理を必要とする危険性があるかどうかを判断するために、ハザード分析を実施しなければならない。 |
103 |
1. FSVP策定
食品安全近代化法(FSMA)に基づき、FDAはほとんどの食品輸入業者に対し、サプライヤーのための外国供給者検証プログラム(FSVP)を作成し、維持することを義務付けています。この要件は、サプライヤーがFDAに準拠し、安全な方法で商品を生産していることを確認するのに役立ちます。
FSVP査察の際、FDAは輸入業者がサプライヤーの食品安全を保証できる完全なFSVPを提示できることを要求しています。2022年度は852 件の FSVP 検査のうち、727 件の輸入業者が FSVP を作成していませんでした。 これは検査を受けた輸入業者の 85% を占めています。FSVPを策定していないことが査察違反の中で最多となったのは、今回で5年連続です。
FSVP に準拠していない輸入業者は、輸入警告(インポートアラート) 99-41 に記載される可能性があり、FSVP 違反者の米国への輸入品は物理的検査なしの即時拘留 (DWPE) の対象となります。
2. 有害生物防除(ペストコントロール)
施設査察の際、FDAは潜在的な有害生物蔓延の兆候を探します。FDAは、食品施設内の有害生物を防止していない、または食品汚染の可能性がある方法で殺虫剤を誤用しているとして、171施設を挙げました。
3. 衛生モニタリング
FDAは162の施設に対し衛生モニタリングに問題があるとしています。これは氷の製造に使用する水を含む食品または食品接触面に接触する水の安全性、食品接触面の状態および清潔さ、不衛生な物体からの二次汚染の防止、手洗い、手指消毒、およびトイレの設備の維持、食品、食品包装材、および食品接触面の不純物混入の防止、有害化学物質の適切な表示、保管などを含む現行の適正製造基準への適合を保証するのに十分な対応がない、という内容です。
4. 製造管理
製造、加工、梱包、および保管の管理における問題が発覚した施設は、155件ありました。これは、施設が、潜在的な微生物の増殖、アレルゲンの交差汚染、または食品の汚染と劣化の可能性を最小限に抑えるような条件下でオペレーションを行っていなかったというものです。
5. 人員
2022年度の査察で5番目に多く指摘された違反は、従業員に関する衛生問題やその他の適正製造基準に対処していないことが含まれます。FDAはこの違反に対して151件の施設に指摘を行いました。
従業員が、開いている傷や感染した傷など交差汚染の一因となる可能性のある健康状態にある場合、食品の汚染を引き起こす可能性のある食品取扱い作業から当該従業員を除外する必要があります。
また、食品、食品接触面、および食品包装材料と直接接触する人は、アレルゲンの交差接触と汚染を防ぐ衛生慣行を遵守する必要があります。
6. 評価 – 業績、リスク
外国供給業者の業績、食品がもたらすリスク等を判断するために評価を実施したことを文書化していなかった施設が129件ありました。
7. 供給業者の検証 - 書面による手順の確立
供給業者が、輸入する食品に関して適切な外国供給業者の検証活動が実施されることを確実にするための適切な書面による手順を確立していなかった施設が127件ありました。
8. 設備・機器 - 設計とメンテナンス
FDAは設備や器具が、アレルゲンの相互接触、汚染から保護するために、十分な洗浄やメンテナンスができるように設計・構築されていなかったとして115施設に問題があったとしています。
9. 生物的、化学的、物理的なハザード分析
実施したハザード分析に、管理を必要とする既知の、または合理的に予測可能な生物学的、化学的、物理的ハザードが含まれていなかった施設が111件ありました。
10. 仕様 – アイデンティティ、純度、強度、組成
栄養補助食品の、アイデンティティ、純度、強度、組成に関する製品仕様を確立していなかった施設が103件ありました。
10. 工場建設と設計
FDAは工場が、メンテナンスや衛生的な運用を容易にするために建設や設計がされていなかったとして103施設が問題があるとして挙げています。
10. ハザード分析の文書化
管理を必要とするハザードがあるかどうかを判断するため、既知または合理的に予見可能なハザードを特定および評価するためのハザード分析を文書化していなかったとして、FDAは103件指摘しました。
FDAは、施設で製造、加工、包装、保管される食品の種類ごとに、経験、疾病データ、科学的報告、その他の情報に基づいて、既知のまたは合理的に予見可能なハザードを特定・評価し、予防的管理を必要とする危険性があるかどうかを判断するために、ハザード分析を実施することを求めています。
2023年度に向けた準備
Eureka Global Solutionsは、FSVPや製造施設への指摘を回避するお手伝いを致します。今後のFDA査察に向けて準備ができているか不安に感じているということであれば、お手伝いする事ができますのでご連絡ください。弊社の食品安全の専門家が、バーチャルで施設を検査し、FDA査察に合格するためには何をすべきか、適切なアドバイスを提供致します。
2022年12月29日
2022年化粧品規制近代化法(Modernization of Cosmetics Regulation Act of 2022)が法制化
 2022年12月29日、バイデン大統領は、2022年化粧品規制近代化法 (MoCRA) を含む 2023年連結歳出法に署名しました。
2022年12月29日、バイデン大統領は、2022年化粧品規制近代化法 (MoCRA) を含む 2023年連結歳出法に署名しました。
MoCRA は米国食品医薬品局 (FDA) の米国における化粧品の規制を大幅に拡大し、連邦食品医薬品化粧品法 (FDCA) を修正し、化粧品に関連する広範な新しい要件を課しています。MoCRAの下では、化粧品会社は、施設の登録と製品リストの要件、適正製造基準 (GMP)、重大な有害事象の報告と記録管理、および安全性の立証等の規制対象となります。さらに、MoCRAは、FDAに、化粧品の強制リコールを命じたり、FDA が深刻な健康上の懸念があると判断した場合に施設登録を一時停止する権限をも付与します。改正されたMoCRA の主な概要は以下のとおりです。
FDCA Section 605: 有害事象の記録管理と重大な有害事象の報告
責任者は、製造、梱包、または配布された化粧品の米国内での使用に関連する「重大な有害事象」についての情報受領後 15営業日以内に、FDAに報告する必要があります。 さらに、最初の提出から1年間、責任者は最初の報告に関連する新しい重要な医療情報を受領後 15 営業日以内に FDA に提出しなければなりません。「重大な有害事象」とは、化粧品の使用に関連した健康に関する有害事象で、死亡、生命を脅かすような状況、入院、持続的または重大な障害や能力喪失、先天異常または出生異常、感染、または深刻な損傷をもたらすもの、と定義されています。
責任者は、有害事象の報告を受けるために、米国内の住所、米国内の電話番号、または電子連絡先情報を化粧品のラベルに含める必要があります。
責任者は、責任者が製造、梱包、または販売した化粧品の国内使用に関連する有害事象の報告に関する記録 6年間保持する必要があります。特定の小規模企業は、そのような記録を3年間保持する必要があります。
FDCA Section 606: 適正製造基準(GMP)
MoCRAは、国内および国際基準と一致した、化粧品の製造および加工施設に関する GMP規則の制定をFDAに要求しています。さらに、FDAは、FDAがGMPへの準拠を証明するために必要な記録を検査できるようにする規則を制定する可能性があります。FDAは、MoCRA 制定後2年以内に規則案を発行し、3 年以内に最終規則を発行する必要があります。
FDCA Section 607: 施設登録と製品および成分のリストの義務化
米国で流通する化粧品の製造または加工に従事する米国内外の既存の各施設は、MoCRA の制定後1年以内 (2023年12月29日まで) にFDAに登録する必要があります。新しい施設は化粧品の製造を開始してから60日以内、または既存の施設の期限から 60 日以内のいずれか遅い方までに登録する必要があります。施設登録は隔年で更新する必要があります。化粧品のラベル付け、再ラベル付け、包装、または再包装のみを行う施設は、FDAに登録する必要はありません。なお、米国外の施設には米国代理人が必要です。
責任者は、MoCRAの制定の1年後までに、成分を含む各化粧品を FDAにリストアップする必要があります。MoCRAの制定後に販売開始される製品については、責任者は販売開始後120日以内に製品リストを提出しなければなりません。さらに、責任者は製品リスト情報を毎年更新する必要があります。
FDCA Section 608: 化粧品の安全性の立証
責任者は、化粧品の安全性が十分に実証されていることを裏付ける記録を確保し、維持する必要があります。 「安全性の十分な立証」とは、化粧品とその成分の安全性を評価するための科学的知識と経験を有する専門家の間で、化粧品が安全であるという合理的な確信を裏付けるのに十分であると考えられる試験または研究、調査、分析、その他の証拠または情報のことであると定義されています。 MoCRAでは、「安全」とは、ラベルに規定された使用条件、または慣習的または通常の使用条件の下で、化粧品がユーザーに害を及ぼさないことを意味します。十分な安全性の立証がなされていない化粧品は、FDCA第601条に基づき、adulterated(粗悪品)とみなされます。
FDCA Section 609: 化粧品の表示と香料アレルゲンの透明性
今回の改正で追加されたFDCA Section 609 は、FDAの現在の化粧品表示要件について3 つの方法を示しています。 第一に、MoCRA は、化粧品のラベルに、責任者が有害事象の報告を受け取ることができる連絡先情報を含めることを義務付けています(MoCRA の制定日から 2年後に発効)。第二に、MoCRAは、サロンなどプロが使用する化粧品のラベルに、消費者への販売を目的とした化粧品に必要とされるのと同等の情報を含めることを要求しており、認可された専門家のみが製品を使用できることを述べる必要があります(MoCRAの制定日から1年後に発効)。第三に、MoCRA は、FDA が香料アレルゲン規則(下記参照)を発行後、化粧品ラベルに製品内の各香料アレルゲンを識別することを求めています。
今回の改正でMoCRAは、EUの要件やその他の国際的な要件を考慮して、化粧品のラベルに開示しなければならない香料アレルゲンを特定するための規則を発行するようFDAに指示しています。FDAは、制定後18か月以内に規則案を発行し、規則案に対するパブリックコメント期間の終了後 180日以内に最終規則を発行します。
FDCA Section 614: プリエンプション(連邦法 に矛盾する州法を無効にすること)
MoCRAには、登録や製品リスト、GMP、記録、リコール、有害事象報告、安全性の立証に関して連邦法と異なるものを州が制定することを禁止する明確なプリエンプション規定があります。
一括法案 Section 3505: タルク規則
一括法案のSection 3505 は、タルク含有化粧品中のアスベストを検出するための標準化された試験方法を確立し、要求する規則を発行するよう FDA に指示しています。FDAは、MoCRA制定後1年以内に規則案を発行し、規則案に対するパブリック コメント期間の終了後 180 日以内に最終規則を発行しなければなりません。
一括法案 Section 3506: PFAS報告
一括法案のSection 3506 は、化粧品におけるパーフルオロアルキル物質およびポリフルオロアルキル物質(PFAS)の使用と、化粧品におけるそれらの使用の安全性に関する科学的証拠を評価するために、FDAに対して、この評価の結果をMoCRA制定後 3 年以内に公開報告書として公表することを要求しています。
小規模企業への便宜
MoCRAは小規模企業に対して多くの便宜を図っており、Section 606のGMP規制については、小規模企業に対しては、フレキシブルで簡素化された要件を提供し、準備のためにより長い遵守期間を与えます。そして、非常に小規模な企業(MoCRAにより定義される)は、Section 606(GMP)およびSection 607(施設登録、製品および成分のリスト)を免除され、Section 605(有害事象の記録管理と報告)については、上述の通り、製品の使用に関連する健康関連の有害事象の記録を6年間ではなく、3年間保持することとなっています。
2022年11月29日
FDA、食品アレルゲン表示要件に関するガイダンス案を発表
 米国食品医薬品局(FDA)は、連邦食品・医薬品・化粧品法の食品アレルゲン表示要件を含む食品アレルギー原因物質(以下、アレルゲン)に関するQ&A(質問と回答)を更新するガイダンス案の第5版を発表しました。今回の第5版は、2021年食品アレルギー安全・処置・教育および調査に関する法律:Food Allergy Safety, Treatment, Education, and Research(FASTER)法および2004年食品アレルゲン表示・消費者保護(FALCPA)法の要件を含む、食品アレルゲンの表示に関連するQ&Aの新規および改訂により、旧版(第4版)を更新するものとなっています。具体的には、9つ目の主要な食物アレルゲンであるゴマを含むようにQ&Aを改訂し、特にバルク食品、遺伝子工学によって製造された食品、タンパク質不使用の原材料、栄養補助食品に対するアレルゲン表示に関するQ&Aが含まれます。
米国食品医薬品局(FDA)は、連邦食品・医薬品・化粧品法の食品アレルゲン表示要件を含む食品アレルギー原因物質(以下、アレルゲン)に関するQ&A(質問と回答)を更新するガイダンス案の第5版を発表しました。今回の第5版は、2021年食品アレルギー安全・処置・教育および調査に関する法律:Food Allergy Safety, Treatment, Education, and Research(FASTER)法および2004年食品アレルゲン表示・消費者保護(FALCPA)法の要件を含む、食品アレルゲンの表示に関連するQ&Aの新規および改訂により、旧版(第4版)を更新するものとなっています。具体的には、9つ目の主要な食物アレルゲンであるゴマを含むようにQ&Aを改訂し、特にバルク食品、遺伝子工学によって製造された食品、タンパク質不使用の原材料、栄養補助食品に対するアレルゲン表示に関するQ&Aが含まれます。
ガイダンスの第4版が発行された2006年以降、アレルゲン表示の取り組みが進展し、新しい食品が導入され、ゴマが主要な食物アレルゲンとして追加されました。このガイダンス案には、業界が長年にわたって提起してきた多くの質問が含まれており、FDAの回答は以下の通りです。
- 主要な食物アレルゲンに由来するタンパク質を含まない原材料は、アレルゲン表示義務の対象外です。これは、高度精製油、香料、着色料など、主要な食物アレルゲン由来のタンパク質を含まない原材料や、タンパク質を含まない原材料を確実に製造する技術を用いて加工され、製造者が原材料にタンパク質が含まれていないことを保証できる場合のみです。
- 木の実などのアレルゲン部分とは異なり根、葉、茎、樹皮などは、主要な食物アレルゲンではないため、食物アレルゲン表示義務の対象とはなりません。例えば、ウィートグラス(小麦若葉)やココナッツの樹液から作られるココナッツシュガーには、食品アレルゲン表示要件は適用されません。
- 食物アレルゲン表示義務は、遺伝子工学の利用により生成された主要な食物アレルゲン由来のタンパク質を含む、あるいは主要な食物アレルゲンのDNA配列を用いて生産された原材料に適用されます。
- 交差接触により意図せず食品に取り込まれた主要な食物アレルゲンは、アレルゲン表示義務の対象とはなりません。FDAは、このガイダンスの以前の版と同様に、作物の栽培・収穫の慣習的方法、保管・輸送・生産設備の共用などの原因により交差接触が起こりうることを知っています。FDAは、cGMPおよびFSMAのハザード分析およびリスクベースの予防管理規則による交差接触をコントロールすることの重要性を強調していますが、そのような対策でも交差接触を完全に防ぐ事ができない場合、メーカーにより、交差接触の可能性についてアレルギー警告文言を表示しているところもあります。
- 食物アレルゲン表示要件は、再利用可能なバルク容器や、さらに加工するために企業間で輸送されるバルク食品の容器にも適用されます。
- 複数ユニットが入っている小売食品パッケージの個々のユニットのパッケージも、アレルゲン表示要件の適用は免除されていません。ユニットのパッケージに原材料リストが記載されていない場合は、アレルゲン表示をするべきで、FDAはこの表示は識別表示の近くに配置することを提案しています。しかし、個々のパッケージが製品の保護のみを目的としたラベルのない内側のスリーブ(「パッケージ・ライナー」と呼ばれることもある)で、文字、印刷、図表を含まない場合は、アレルゲン表示を含むラベル表示は不要です。
- 主要な食物アレルゲンを含む付随的な添加物を用いて製造された食品のラベルには、主要な食物アレルゲンの食品源を宣言することが要求されます。
- 「含有する」旨の記述には、主要な食物アレルゲン以外の食物アレルゲンや、個人が敏感な可能性のある食物アレルゲンでない食品物質を含んではいけません。例えば、「マスタードを含む」、「グルテンを含む」は使用すべきではありません。
- 魚には、サメ、エイ、ガンギエイなどの軟骨魚が含まれます。
- ココナッツは木の実です。
- 栄養補助食品のSupplement Factsの成分ラベル内で主要な食物アレルゲンが表示されている場合は、栄養補助食品ラベルの他の場所で再度表示する必要はありません。栄養補助食品のSupplement Factsに成分リストが含まれていない場合、「含有する」の文言で、Supplement Factsに隣接して表示されている必要があります。
- 食物アレルゲン表示義務は、航空会社およびその他の輸送機関の機内で提供または販売されるすべての包装された食品に適用されます。
- 食物アレルゲン表示義務は、ペットフード、動物用飼料、化粧品、家庭用クリーニング剤には適用されません。
FDAはガイダンスの第4版を最終化し、コメントを検討し必要な変更を取り入れた後、第5版のQ&A(質疑応答)を最終ガイダンス文書として公表します。連邦官報に掲載されてから60日以内(2023年1月29日まで)に、第5版の質疑応答に対するコメントを整理番号FDA-2022-D-0099を用いてオンライン又は書面にて提出することができます。書面によるコメントは以下に提出可能です。
Dockets Management Staff
Food and Drug Administration
5630 Fishers Lane, Rm 1061
Rockville, MD 20852
追加情報のリンクは以下の通りです。
- Federal Register Notice of Availability
- Draft Guidance for Industry: Questions and Answers Regarding Food Allergens, Including the Food Allergen Labeling Requirements of the Federal Food, Drug, and Cosmetic Act (Edition 5)
- Final Guidance for Industry: Questions and Answers Regarding Food Allergens, Including the Food Allergen Labeling Requirements of the Federal Food, Drug, and Cosmetic Act (Edition 5)
- Food Allergies
- Food Allergens/Gluten-Free Guidance Documents & Regulatory Information
- FASTER Act Video - FASTER法に関する基本情報を含み、食品業界やその他関係者からFDAに寄せられたよくある質問への回答に役立ちます。
2022年11月16日
FDA、鶏の細胞から培養されたヒト用食品を認可
 世界中で食糧革命が進んでおり、米国食品医薬品局(FDA)も食糧供給におけるイノベーションの支援に取り組んでいます。その取り組みの一例としてFDAは、培養動物細胞から作られたヒト用食品について初めて市場前協議を完了した(認可した)ことを発表しました。
世界中で食糧革命が進んでおり、米国食品医薬品局(FDA)も食糧供給におけるイノベーションの支援に取り組んでいます。その取り組みの一例としてFDAは、培養動物細胞から作られたヒト用食品について初めて市場前協議を完了した(認可した)ことを発表しました。
FDAは、UPSIDE Foodsが培養した鶏の細胞を用いた食品について、提出された情報を評価した結果、培養肉の安全性に関する結論について現時点ではさらなる質問はないとしています。
この食品が市場に出る前に、製造施設はFDAの要件だけでなく、適用される米国農務省(USDA)の要件についても満たす必要があります。細胞培養部分の施設登録などのFDAの要件に加え、製造施設は収穫及び収穫後の部分についてUSDAの食品安全検査局(FSIS)からの検査許可証が必要で、製品自体にはUSDAの検査マークが必要となります。
細胞培養技術の規制は、培養された家畜または家禽の細胞から作られた食品について、USDA-FSISとFDAで協力的かつ密接に連携して行われています。2019年3月の正式合意により、両機関はFDAが細胞採取、細胞バンク、細胞の増殖・分化を監督する共同規制の枠組みに合意しました。培養動物細胞由来の製品を規制するためのFDAのアプローチには、徹底した市販前協議プロセスが含まれ、協議に関連するすべての疑問が解決された時点で終了します。細胞の採取の段階で、FDAからUSDA-FSISに監督当局が移行されます。USDA-FSISは家畜・家禽の細胞に由来するヒト食品の収穫後の処理とラベリングを監督します。このように密接に連携した規制アプローチにより、家畜・家禽の細胞由来の細胞培養製品が連邦規制に適合し、正確にラベル付けされることが保証されます。両機関は、これらの製品が適用されるすべてのFDAおよびUSDA-FSISの要件を満たすよう、メーカーと協力しています。
細胞培養技術の進歩により、食品開発者は家畜、家禽、魚介類から得た動物細胞を食品の製造に使用できるようになり、これらの製品は近い将来、米国市場に投入されることが期待されています。FDAは、米国の消費者にとって食品の安全性を常に第一優先としながら、食品技術の革新を支援することを目標としています。FDAは、生物学的システムやバイオテクノロジーの利用を含む幅広い食品製造技術において、食品安全性評価に関する豊富な経験を有しており、消費者の要求や嗜好に応えるために業界の慣行が進化していく中で、FDAは常に新しい物質を評価しています。培養動物細胞を用いた食品は、FDAが規制する他のすべての食品と同様に、安全性要件を含む厳しい要件を満たす必要があります。
FDAは、培養動物細胞食品および製造プロセスを開発する企業と協力し、その製品が連邦食品・医薬品・化粧品法の下で安全かつ合法であることを保証する準備が整っています。また、培養動物細胞からヒト用食品を製造しようとする企業が、市販前協議の準備をするのを支援するためのガイダンスについても発行予定です。このガイダンス案には、パブリックコメントを求める正式な機会がある予定です。FDAはすでに、FDAのみが監督することになる魚介類の細胞を含む培養動物細胞から作られる様々な種類の製品について複数の企業と話し合いを進めており、FDAに申請する前に、製品開発段階の早い段階で、頻繁にFDAと対話することを企業に推奨しています。
追加情報のリンクは以下の通りです。
- Constituent Update: FDA Completes First Pre-Market Consultation for Human Food Made Using Animal Cell Culture Technology
- Human Food Made with Cultured Animal Cells
- Overview of FDA and USDA Roles and Responsibilities for Cultured Animal Cell Human and Animal Food Products Webinar
- FDA response letter to the firm
- FDA’s scientific review memo of the firm’s product
2022年9月28日
FDA、食生活改善と慢性疾患の減少のためクレーム「ヘルシー」の定義更新提案
 米国では80%以上の人が野菜、果物、乳製品を十分に食べていません。また、ほとんどの人が添加糖、飽和脂肪酸、ナトリウムを過剰に摂取しています。そこで、米国食品医薬品局(FDA)は、食品のパッケージに栄養成分表示「ヘルシー」を表示する場合の基準を改定することを提案しました。この規則案における新しい「ヘルシー」の定義は、現在の栄養科学、最新の栄養成分表示、および「アメリカ人のための食事ガイドライン2020-2025」に沿ったものとなっています。
米国では80%以上の人が野菜、果物、乳製品を十分に食べていません。また、ほとんどの人が添加糖、飽和脂肪酸、ナトリウムを過剰に摂取しています。そこで、米国食品医薬品局(FDA)は、食品のパッケージに栄養成分表示「ヘルシー」を表示する場合の基準を改定することを提案しました。この規則案における新しい「ヘルシー」の定義は、現在の栄養科学、最新の栄養成分表示、および「アメリカ人のための食事ガイドライン2020-2025」に沿ったものとなっています。
この規則案は、2030年までに飢餓をなくし、栄養と身体活動を改善し、食事に関連する病気を減らし、格差をなくすことを目的とした「飢餓、栄養、健康に関するホワイトハウス会議」と、それに関連する国家戦略の発表を受けて出されたものです。
米国では、食事に関連する慢性疾患が死亡や身体障害の主な原因となっています。果物、野菜、低脂肪乳製品、全粒粉を含む健康的な食事パターンは、心血管疾患、2型糖尿病、特定の種類の癌、過体重や肥満のリスクの減少など、健康増進と関連しています。情報量が多く、アクセスしやすい食品表示を行うことは消費者に役立ち、一部のメーカーが製品に含まれる果物、野菜、乳製品、全粒粉を増やし、飽和脂肪酸、ナトリウム、添加糖を制限すれば、より健康な食品供給を促進できる可能性があります。
今回の規則案は、様々な食品群に含まれるすべての栄養素が、健康的な食事パターンを作り、健康を増進するためにどのように役立ち、相乗的に作用し得るかをより良く考慮して、「ヘルシー」クレームの定義を更新するものです。最新の栄養科学に基づく「ヘルシー」クレームの定義案では、ナッツや種子類、脂肪の多い魚(サーモンなど)、特定の油、水など、健康的な食事パターンの一部として食事ガイドラインで推奨されている多くの食品が、ラベルに「ヘルシー」のクレームを使用できるようになります。
提案された定義では、食品包装に「ヘルシー」のクレームを表示するためには、製品は以下のことが必要となります。
- 食事ガイドラインで推奨されている食品群またはサブグループ(果物、野菜、乳製品など)が少なくとも1種類、一定量以上含まれていること。
- 飽和脂肪酸、ナトリウム、添加糖などを一定量以上含んでいないこと。
それらの栄養素や成分の上限値/下限値は、その栄養素の1日の摂取量(DV)の割合に基づいており、食品や食品群によって異なります。例えばシリアルの場合、4分の3オンス(約21g)以上の全粒穀物を含み、飽和脂肪酸は1g以下、ナトリウムは230mg以下、添加糖は2.5g以下である必要があります。
2020-2025年の食事ガイドラインでは、カロリー制限の範囲内で栄養価の高い食品と飲料で食品群のニーズを満たすことに重点を置いた健康的な食事パターンを推奨しています。この推奨においては、良い栄養は個々の栄養素の摂取から得られるのではなく、様々な栄養素が複合的に作用する食品から得られるとされていて、食事ガイドラインでは、健康的な食事パターンには、野菜、果物、穀物、乳製品、タンパク質食品、油脂が含まれると具体的に説明されています。FDAは、限られた栄養素だけに注目するのではなく、食品群を「ヘルシー」の基準とすることで、現在の栄養科学や連邦政府の食事指導と一致し、消費者が健康的な食生活を維持するのに役立つ食品をより良く特定できると提案しています。
FDAは、特定の食品が「ヘルシー」な栄養成分を表示するための基準を知らせるために、「食品群相当量」を使用することを提案しています。食品群相当量とは、「ヘルシー」を謳うために食品に含まれなければならない食品群の量を指し、以下のように定義されています。
| 食品群 | 食品群相当量 |
|---|---|
野菜 |
1/2カップ相当の野菜 |
果物 |
1/2カップ相当の果物 |
穀物 |
3/4オンス以上の全粒穀物 |
乳製品 |
3/4カップ相当の乳製品 |
タンパク質食品 |
1.5オンス相当の肉類 |
新しい「ヘルシー」の定義を策定することによって、消費者が健康的な食品を入手しやすくなるだけでなく、食品メーカーが、野菜や全粒穀物などをより多く用いた健康的な食品供給を促進するのに役立つ可能性があります。
また、これとは別に、メーカーが、自社製品が「ヘルシー」の定義を満たしていることを示すために、パッケージの前面に使用できるシンボルについてもFDAは研究中です。
2023年2月16日までに、整理番号FDA-2016-D-2335を用いてコメントをオンライン又は書面にて提出することができます。書面によるコメントは以下に提出可能です。
Dockets Management Staff
Food and Drug Administration
5630 Fishers Lane, Rm 1061
Rockville, MD 20852
追加情報のリンクは以下の通りです
- Proposed Rule: Food Labeling: Nutrient Content Claims; Definition of Term “Healthy”
- Consumer Update: A Fresh Take on What "Healthy" Means on Food Packages
- Press Release: FDA Proposes Updated Definition of ‘Healthy’ Claim on Food Packages to Help Improve Diet, Reduce Chronic Disease
- Use of the Term Healthy on Food Labeling
- FDA’s Nutrition Initiatives
2022年7月20日
FDA、一部の紫外線照射器(UVワンド)の使用について警告
 米国食品医薬品局(FDA)は、消毒を目的に販売されている紫外線照射器(UVワンド)の中には、ユーザーや近くにいる人に健康上のリスクをもたらす可能性があるものがある、と警告しています。
米国食品医薬品局(FDA)は、消毒を目的に販売されている紫外線照射器(UVワンド)の中には、ユーザーや近くにいる人に健康上のリスクをもたらす可能性があるものがある、と警告しています。
特定のブランドのUVワンドはたった数秒の使用によりユーザーや近くにいる人が危険なレベルの紫外線(UV-C)にさらされ、皮膚、目、またはその両方を傷つけるリスクがあるので使用しないようFDAは消費者向けに警告しています。家庭用の消毒を目的とした安全でないUVワンドが販売されているため、これらの製品を使用せず、より安全な代替手段を検討するよう推奨しています。
以下が対象となる製品の一覧です。これらの製品は、別の名称で表示されている場合もありますので要注意です。FDAは、メーカーによる是正措置が実施された際や安全でない製品が新たに発見された場合にリストを更新していく予定です。
| 製品 | メーカー |
|---|---|
| Safe•T•Lite | Max‐lux Corporation |
| OttLite Rechargeable UVC Disinfecting Wand, model: UV10002M | OttLite Technologies Inc. |
| UVILIZER Flip, model: SG-153 | In My Bathroom LLC, “dba” IMB |
| Portable UV Light Wand Sterilizer | In My Bathroom LLC, “dba” IMB |
| Ultraviolet Sterilamp, model: PURPLEGLOW | Vanelc |
| Sharper Image® UV Sanitizing Portable Wand, model: 101362 | MerchSource LLC |
| SurfaceSoap UV | PhonoSoap LLC |
| Magic UV Light SanitizerTM | Magic UV Light Sanitizer |
消費者への推奨事項
- 上記の UV ワンドは使用しないこと。
- FDAのテストによると、上記のUVワンドは安全でないレベルの紫外線を放射しているため、ユーザーや近くにいる人の目や皮膚にケガをさせる可能性があることに注意すること。
- 上記のUVワンドは、危険なレベルの紫外線放射によるユーザーや周囲の人へのケガのリスクを軽減するための十分な安全機能がないことに注意すること。
- 安全に関する説明や、放射線に関連するリスクの情報がないUVワンドは使用しないこと。
- 紫外線の照射から皮膚や目を保護する方法など、UVワンドに同梱されている安全に関する全ての説明書に従うこと。
- 家庭内などの空間においては、細菌のための化学洗剤など代替消毒法の使用を検討すること。
- UVライトとランプ:紫外線照射、殺菌、コロナウイルスについての詳細を読むこと。
製品の概要と背景
UVワンドは、紫外線を照射して表面を消毒することを目的とした携帯型の製品で、一般に医療現場以外で使用されています。FDAがテストした製品の中には、ユーザーや近くにいる人が危険なレベルの紫外線に晒されることを示す製品がありました。また、FDAは、安全性情報の欠如、数秒で消毒するという宣伝文句、ユーザーを保護する手段の欠如など、テストされた製品に共通する問題点を指摘しました。
数秒で消毒できると宣伝している製品は、安全でないレベルの紫外線を放射している可能性があります。FDAのテストでは、UVワンド製品の中には、約2インチの距離で、国際非電離放射線防護委員会によって推奨される曝露限界の3,000倍の紫外線を放つものがある事が判明しました。上の表に記載されているUVワンドのユーザーや近くにいる人は、数秒の照射で皮膚(紅斑、火傷のような皮膚反応)や目(光線角膜炎)の傷害を受ける可能性があります。紫外線の照射に伴う目の傷害は、激しい痛みと目に砂が入ったような感覚を引き起こします。
FDA の措置
FDAは、複数のメーカーからUVワンドのサンプルを収集し、テストを行いました。FDAは、製品が安全でないレベルの放射線を発し、消費者に重大な傷害を与える危険性があることが判明したメーカーに対して、欠陥通知書(Notification of Defect Letters)を発行しそれらのメーカーに対して適切な是正措置を要求する予定です。
製品に関する問題の報告
メーカーだけでなく、誰でも以下のフォームを使用して放射線事故または潜在的に危険な事象に関する報告をFDAに提出する事ができます。
放射線事故報告書フォーム(Accidental Radiation Occurrence Report form)
また、消費者は、規則違反申立てフォーム(Allegations of Regulatory Misconduct Form)を通じて情報を提出する事もできます。そのような情報は、安全でないレベルの放射線を放つ可能性のあるUVワンドをFDAが特定するのに役立ちます。
ご参考のため追加情報のリンクは以下の通りです。
- ICNIRP Guidelines on Limits of Exposure to Ultraviolet Radiation of Wavelengths Between 180 nm and 400 nm (Incoherent Optical Radiation)
- Ultraviolet (UV) Radiation
2022年7月19日
FDA、フッ素化ポリエチレン製食品接触容器に関するRFI(情報提供依頼書)を発行
米国食品医薬品局(FDA)は、フッ素化ポリエチレンの食品接触用途に関する情報提供依頼書を発行しました。ポリエチレンのフッ素化は、パーフルオロアルキル物質およびポリフルオロアルキル物質(PFAS)の生成につながる可能性があり、この要請は、認可された食品接触用途の安全性を確保することを目的としたものです。FDAは、フッ素化ポリエチレンの現在の食品接触用途に関する科学的データと情報、使用用途に起因する消費者の食事への曝露について、およびフッ素化ポリエチレン食品容器から移行する可能性のある物質に関する安全性情報を求めているものです。
FDAは、1983年に食品と接触する一般的な用途にフッ素化ポリエチレンを認可しました(21 CFR 177.1615)。この規制により、フッ素化工程において特定の製造条件を設定する必要があります。昨年、環境保護庁(EPA)により、農薬が入っているフッ素化ポリエチレン容器から、PFASの一種であるパーフルオロオクタン酸(PFOA)が農薬に移行していることが指摘されました。EPAと連携して、FDAは、食品との接触が認可されていないフッ素化工程が、農薬用容器に使用されている事を認識するようになりました。このような代替フッ素化工程が食品接触製品の製造に使用されないようにするため、FDAは関連業界に対して、食品接触物質(FCS)の製造者の責任として、食品接触材料がすべての適用認可規制における仕様と制限に準拠していることを再確認するよう促す書簡を発行しました。
FDAは、FCSに関する新しい科学的情報を常にモニターしておりこれには、米国および他国の規制当局や保健機関による科学文献や研究のレビューも含まれます。このようなモニタリング活動に基づき、今回FDAは食品と接触するフッ素化ポリエチレンの安全な使用を確実にするために、現状に関する追加情報を求めて情報提供依頼書を発行したものです。
「食品接触用フッ素系ポリエチレン容器に関する情報提供のお願い」に対する意見をFDAが検討できるよう、連邦官報に掲載されてから90日以内に書面またはオンラインでコメントを提出する(提出の際には、整理番号FDA-2022-N-1526を明記)ことが出来ます。
追加情報のリンクは以下の通りです
- Federal Register Notice: Fluorinated Polyethylene Containers for Food Contact Use; Request for Information
- FDA Issues Letter to Industry on Fluorinated Polyethylene Food Contact Containers
- Authorized uses of PFAS in Food Contact Applications
2022年7月6日
FDA、魚介類のPFAS試験結果を公表
 米国食品医薬品局(FDA)は、魚介類サンプル中のパーフルオロアルキル物質およびポリフルオロアルキル物質(PFAS) の検査結果を公表しました。FDAは、PFASの食品中の含有量に関してより対象を絞った、あるいはより大規模な魚介類の調査を実施すべきかどうかを判断するために、調査を実施したものです。アサリ、タラ、カニ、スケトウダラ、サケ、エビ、マグロ、ティラピアの81のサンプルを検査しましたが、サンプリングのほとんどが輸入品でした。FDAは、最新の科学を活用し、毒性学的基準値を有するとされているPFASを個別に評価した結果、中国産のアサリ缶サンプルから検出されたPFASの一種であるペルフルオロオクタン酸(PFOA)の推定曝露量は、健康への懸念がある可能性が高いと判断しました。PFOA濃度が最も高かった2つのアサリ缶サンプルについては、1カ月に約10オンス(oz)以上(ただし、幼児は1カ月に2オンス)食べると健康上のリスクがあると懸念されるとしています。
米国食品医薬品局(FDA)は、魚介類サンプル中のパーフルオロアルキル物質およびポリフルオロアルキル物質(PFAS) の検査結果を公表しました。FDAは、PFASの食品中の含有量に関してより対象を絞った、あるいはより大規模な魚介類の調査を実施すべきかどうかを判断するために、調査を実施したものです。アサリ、タラ、カニ、スケトウダラ、サケ、エビ、マグロ、ティラピアの81のサンプルを検査しましたが、サンプリングのほとんどが輸入品でした。FDAは、最新の科学を活用し、毒性学的基準値を有するとされているPFASを個別に評価した結果、中国産のアサリ缶サンプルから検出されたPFASの一種であるペルフルオロオクタン酸(PFOA)の推定曝露量は、健康への懸念がある可能性が高いと判断しました。PFOA濃度が最も高かった2つのアサリ缶サンプルについては、1カ月に約10オンス(oz)以上(ただし、幼児は1カ月に2オンス)食べると健康上のリスクがあると懸念されるとしています。
健康上の懸念として、発育への影響、肝機能の変化、免疫反応の低下、特定の種類のがんの増加などの深刻な健康被害と関連するリスクがあることが研究により示されています。アサリで検出されたPFOA以外のPFASのレベル、および他の魚介類サンプルで評価されたPFASのレベルは、健康上の懸念に繋がる可能性はないと現状では判断されています。FDAは、輸入アサリ缶に含まれるPFOAおよびアサリ全体に含まれるPFASのレベルを把握し、米国の食糧供給への安全性を確保するための措置を講じるよう取り組んでいます。
PFOAの含有量が最も高かった2つのサンプルの販売会社2社は、自社製品に対するFDAの検査結果を受け、全製品を自主回収(リコール)することを発表しました。
FDAは、潜在的な汚染源について理解を深めるため、製品サンプルの収集を行ったすべてのアサリ缶販売業者と連携しアサリ缶中のPFOA濃度を低減するなど、各販売会社が消費者のPFOA曝露を減らすための行動を起こすのに役立てるように働きかけています。今後、FDAは、輸入品および国内で収穫されたアサリ缶と生のアサリ両方について、PFASレベルについてより深く理解し、公衆衛生を守るための最善の方法を決定するため、広範な試験を実施する予定です。
中国およびヨーロッパ産のアサリに関する他の科学文献では、高濃度を含むさまざまなレベルのPFOAが報告されています。科学が発展し、FDAの研究者と食品安全の専門家が食品中のPFASに関する理解を深めていく過程で、FDAは食品中のPFASに対する規制アプローチに役立つデータを収集し、新しい情報を入手次第公開していく予定です。また、追加の企業行動に関する情報についても更新する予定です。
FDAは魚介類に関する食生活を変えるべきかどうか迷っている消費者に対し、魚介類を含む、年齢に応じた様々な健康的な食品を家族で食べることを改めて勧めています。魚介類には、子供には脳の発達や免疫力の向上、大人には心臓や骨の健康、特定の癌のリスクの低減などを含む、多くの栄養上の利点があります。しかし、中国産のアサリ缶を定期的に食べたり子供に食べさせたりしている人は、もう少しPFOAについての詳細が判明するまで摂取量を控えた方が良いかもしれません、としています。
追加情報のリンクは以下の通りです
- Per- and Polyfluoroalkyl Substances (PFAS)
- Testing Food for PFAS and Assessing Dietary Exposure
- Analytical Results of Testing Food for PFAS from Environmental Contamination
- Questions and Answers on PFAS in Food
2022年5月19日
食品包装材および食品接触用途のフタル酸エステル類に関する請願書へのFDAの対応
FDAは、産業界が使用を停止した事を背景に、食品添加物規制を改正しほとんどのフタル酸エステル類を食品接触用途に使用できないようにしました。FDAは、可塑剤、接着剤、消泡剤、表面潤滑剤、樹脂、ヌメリ防除剤として使用されていた23のフタル酸エステル類と他の2つの物質の食品接触用途の認可を取り消しました。これら25物質の食品接触用途の削除はFlexible Vinyl Alliance(ビニールの業界団体)が、請願書において、産業界がこの25の物質の使用を既に停止していることを実証したことによるものです。
この措置により、規制上、食品接触用途におけるフタル酸エステル類の使用は、可塑剤として認可された8種類とモノマーとして認可された1種類の合計9種類に制限されることになります。FDAは残りのフタル酸エステル類の現在の使用状況をより良く理解するために、可塑剤として使用が認可されている8種類のフタル酸エステル類について、現在の食品接触用途、使用レベル、食事への曝露、安全性に関するデータについての情報を業界に要請しました。なお、モノマーとして使用が許可されているフタル酸エステルについては、この使用による曝露はごくわずかであると考えられるため、情報提供の要請は行いませんでした。
一方、FDA は、複数の公益団体から提出された別の食品添加物請願書を却下しました。この請願書は、食品添加物規制を撤回し、28 種類のフタル酸エステル類全ての食品接触用途を削除することを要求するものでした。この食品添加物請願は、28種のフタル酸エステル類すべてを1つのクラスとしてまとめ、安全性の懸念に基づき、食品添加物規制から削除することを提案したものです。FDAは、この申請に対し、28種類のフタル酸エステル類を1つのクラスに分類し食品添加物の使用に対して全てが安全でないと実証するものではないと判断しました。FDAの連邦官報通知には、申請の主張に対するFDAの回答詳細が掲載されています。結果的にFlexible Vinyl Allianceの食品添加物嘆願書のみを受け入れたので他の公益団体の食品添加物嘆願書で削除を要請した28種類のフタル酸エステル類のうち23種類についてのみ食品添加物認可が取り消された形になりました。
FDA、食品接触用途におけるフタル酸エステル類の使用と安全性に関する最新データを業界関係者に求める
FDAは、食品接触用途の可塑剤として使用が許可されている残りのフタル酸エステル類について、利用可能な用途と安全性に関する情報の提供を要請しました。FDAは、一般公開されているフタル酸エステル類に関する最新の毒性学的および使用情報は把握しているものの、業界関係者は未公開の情報を持っている、またはそのような情報にアクセスできる可能性があるためです。
FDAは、メーカーによる使用停止に基づく食品添加物申請に対する今回の措置後も、可塑剤として食品接触用途での使用が許可されている残りの8種類のフタル酸エステル類について、具体的な現在の食品接触用途、使用レベル、食事への曝露、安全性に関する科学的データおよび情報を求めています。これらの情報をもとに、FDAは現状許可されているフタル酸エステル類の食品接触用途に関する食事曝露の推定値および安全性評価を更新する可能性があります。
追加情報のリンクは以下の通りです
- Final Rule: Indirect Food Additives: Adhesives and Components of Coatings; Paper and Paperboard Components; Polymers; Adjuvants, Production Aids, and Sanitizers (Docket No. FDA-2018-F-3757)
- Federal Register Notice: Natural Resources Defense Council, et al.; Denial of Food Additive Petition; Denial Without Prejudice of Food Additive Petition (Docket No. FDA-2016-F-1253)
- Federal Register Notice: Ortho-phthalates for Food Contact Use; Request for Information (Docket No. FDA-2022-N-0571)
- Response to Citizen Petition (found in Docket No. FDA-2016-P-1171)
- Phthalates in Food Packaging and Food Contact Applications
2022年3月16日
合成ニコチン製品がFDAの管轄下に
 3月15日、ジョー・バイデン大統領は、連邦食品医薬品化粧品法(FD&C法)第201条の「タバコ製品」の定義を、「タバコから製造または派生した、あるいはニコチンを含む、ヒトの消費を目的としたあらゆる製品」と改正する法案に署名しました(21 U.S.C. 321(rr))。この新規定により合成ニコチンの「抜け穴」を塞ぎ、合成ニコチン製品も米国食品医薬品局(FDA)のたばこ規制当局の管轄下となりました。
3月15日、ジョー・バイデン大統領は、連邦食品医薬品化粧品法(FD&C法)第201条の「タバコ製品」の定義を、「タバコから製造または派生した、あるいはニコチンを含む、ヒトの消費を目的としたあらゆる製品」と改正する法案に署名しました(21 U.S.C. 321(rr))。この新規定により合成ニコチンの「抜け穴」を塞ぎ、合成ニコチン製品も米国食品医薬品局(FDA)のたばこ規制当局の管轄下となりました。
新規定は法案成立から30日後である2022年4月14日(以下、「施行日」)に施行されました。施行日時点に米国市場で出回っている合成ニコチン製品は、2022年5月14日までの30日間、市場で販売し続ける事ができますが、5月14日が「合成ニコチンPMTA(市販前タバコ製品申請書)提出期限」となりますのでそれ以降も販売するためにはFDAにPMTAを期限内に提出する必要があります。すなわちFDAのコンプライアンスに準拠するためには合成ニコチン製品の製造業者は、期限までにPMTAを提出する事により、施行日からさらに90日間、すなわち2022年7月13日まで販売を継続することができます。但し、2022年7月13日以降は、FDAの認可を受けていない合成ニコチン製品を販売する事はできません。
この新しい法律は、FDAが全ての出所からのニコチンを含むタバコ製品を管轄下とし規制することを明確にしています。
施行日以降、非タバコ用ニコチン(NTN)、すなわち合成ニコチンなどタバコに由来しないニコチンを含むタバコ製品の製造業者、販売流通業者、輸入業者、小売業者は、この法律に起因する連邦食品医薬品化粧品法(FD&C法)の以下のような適用要件を確実に遵守する必要があります。
- 21歳未満にこれらの製品を販売しないこと(店とオンラインの両方)。
- FDAの許可なく、これらの製品をmodified risk tobacco product (MRTP)(リスク修飾(軽減)タバコ製品)として販売しないこと。
- これらの製品の無料サンプルを配布しないこと。
- NTN製品の製造、準備、調合、加工を行う事業所の所有者および運営者は、FDAに登録し、商業流通のために製造、準備、調合、加工するこれらすべてのタバコ製品をリストアップすること。
2022年2月24日
食品によるPFASの削減に向けたFDAの動き
 米国食品医薬品局(FDA)は、食品からの PFAS (フッ素化合物の総称)への潜在的な曝露についてより良く理解し、低減するための作業の一部である新しいテスト結果を発表しました。また、食品包装に使用されている特定の短鎖型PFASの自主的な市場段階的廃止の進捗状況に関する最新情報を共有しました。
米国食品医薬品局(FDA)は、食品からの PFAS (フッ素化合物の総称)への潜在的な曝露についてより良く理解し、低減するための作業の一部である新しいテスト結果を発表しました。また、食品包装に使用されている特定の短鎖型PFASの自主的な市場段階的廃止の進捗状況に関する最新情報を共有しました。
研究
- トータルダイエットスタディ結果
一般的な食品供給に関するFDAの最新の調査結果によると、92の食品サンプルのうち89からはPFASが検出されなかったことが判明しました。3つの魚介類サンプル(ティラピア、タラ、エビ)には、検出可能なレベルのPFASが含まれていました。分析された食品サンプルは、2021年度のトータルダイエットスタディ(TDS)のために収集され、FDAが実施した5セット目の食品供給テストです。現在までに、FDAが2019年以降にテストした532のTDSサンプルのうち、PFASが検出されたサンプルは10ありました。FDAは、これまでにテストしたTDSサンプルで検出されたPFASのレベルには、特定の食品を避ける必要性を示すような科学的根拠は無いとしています。
今回のTDS調査において、FDAは特定の魚介類から検出可能なレベルのPFASを見つけましたが、これまでの調査と同様、サンプル数が限られており、この結果をもって一般的な食品供給における魚介類のPFASレベルについて決定的な結論を導き出すことはできません。米国で一般的に消費されている水産物を対象としたFDAによる調査は現在も進行中で、今年後半に発表予定の結果は、水産物に含まれるPFASの発生状況をよりよく理解し、追加のサンプリングの必要性を判断するのに役立つとみられます。
- 分析方法の拡張
直近の食品サンプルのテストでは、FDAの科学者は、分析方法を従来の16種類から20種類のPFASに拡張しました。追加された4種類のPFAS化合物は、主に魚のサンプリングに関してであり、文献に報告されています。この作業は、FDAが今まで築いてきた分析方法を基に拡張されたもので、食品中のPFASのテストに関する科学を発展させるための作業の一部です。分析方法の拡張詳細については、今年後半に公表される予定です。
特定の短鎖PFASの市場段階的廃止
- 2020年、6:2フルオロテロマーアルコール(6:2 FTOH)を含む短鎖PFASを含む食品接触物質のメーカーは、2021年から3年間の市場段階的な販売停止を約束しました。この合意は、FDAによる市販後の科学的レビューと、潜在的な安全性の懸念を示すデータの分析に従ったものです。
また、メーカーは、毎年進捗状況をFDAに提出することを約束しました。最初の更新は2022年1月31日までに提出する事が要求されました。3社からの最新情報は、ウェブページ「食品接触用途における認可されたPFASの使用」中の「特定の短鎖PFASの市場段階的廃止」のセクションに掲載されています。
2022年2月9日
FDAはEPAによるクロルピリホスの残留許容量レベル取り消し後、ガイダンスを発表
 米国食品医薬品局(FDA)は、「クロルピリホスが残留しているヒト用食品に関する貿易政策 のチャネルに関する質問と回答:業界向けガイダンス」と題するガイダンス文書を発表しました。このガイダンスは、農薬化学物質クロルピリホスの残留物を含む可能性のある食品を取り扱う食品生産者および加工業者のサポートを意図しています。環境保護庁(EPA)は2021年8月30日にクロルピリホスのすべての許容量を取り消す最終規則を発表し、これにより許容量は2022年2月28日に失効します。
米国食品医薬品局(FDA)は、「クロルピリホスが残留しているヒト用食品に関する貿易政策 のチャネルに関する質問と回答:業界向けガイダンス」と題するガイダンス文書を発表しました。このガイダンスは、農薬化学物質クロルピリホスの残留物を含む可能性のある食品を取り扱う食品生産者および加工業者のサポートを意図しています。環境保護庁(EPA)は2021年8月30日にクロルピリホスのすべての許容量を取り消す最終規則を発表し、これにより許容量は2022年2月28日に失効します。
このガイダンスは、連邦食品・医薬品・化粧品法の貿易規定の規定に基づいており、FDAの2005年ガイダンス「業界向けガイダンス: 環境保護庁が食事リスクへの配慮から許容値を取り消し、一時停止、または変更した農薬化学物質の商品に関する貿易政策のチャネル」に記載された方針に従うものです。
貿易規定のチャネルでは、EPAの許容量の有効期限が切れた後、移行期間においてクロルピリホス残留物を含んでいたとしても、許容量の有効期限が切れる前に合法的に使用され、有効期限前の許容範囲内であれば、残留物が存在しているというだけで安全でない、とみなすことは無い、としています。
FDAは、米国農務省(USDA)が規制する食肉、鶏肉などや一部の卵製品を除き、国産および輸入食品に対するEPAの農薬許容値を執行する責任を有しています。
FDAは、移行期間として、生の農産品と加工食品に対し以下のようなアプローチで対処するとしています。
- 第1段階
FDAは、商品により約6ヶ月から24ヶ月の期間、以前の許容値レベル以下である残留量である事を示す文書の提示を要求しないことにより、執行の裁量を行使する意向です。これは、生の農産物が市場に残る期間(栽培と収穫後の保管、流通、販売のための時間)の推定に基づくものです。
- 第2段階
その後、FDAは2022年2月28日以前にクロルピリホスが適用されたことを証明する文書の提示を受け入れます。責任者が適切な書類を提出しない場合、その食品は規制措置の対象となる可能性があります。
EPAの最終規則は、動物向け食品に適用される許容値も取り消します。動物向け食品中の残留物に関する施行は、FDAの獣医学センターが担当し、USDAが規制する食品に関する施行は、USDAが担当します。
FDAは、このガイダンスに関するコメントを受け付けるpublic docketを設けています。オンラインまたは書面によりコメントを提出することができます。
パブリックコメントは、整理番号FDA-2016-D-4484 を用いて https://www.regulations.gov/ にオンラインで提出することが可能です。書面によるコメントは以下に提出できます。
Dockets Management Staff (HFA-305)
Food and Drug Administration
5630 Fishers Lane, Rm. 1061,
Rockville, MD 20852
追加情報:
- EPA Press Release August 2021
2022年1月10日
ハンドサニタイザー/COVID-19
 COVID-19パンデミック時にハンドサニタイザーを供給するために、公衆衛生上の緊急事態下において製造を開始したメーカー以外の元々のメーカーからのアルコール系ハンドサニタイザーの供給が増加し、現在、ほとんどの消費者および医療従事者がアルコール系ハンドサニタイザーを容易に入手する事が出来るようになっています。そのため、FDAは、公衆衛生上の緊急事態以前には医薬品メーカーではなかったメーカーが、アルコール系ハンドサニタイザー、およびハンドサニタイザーに使用するアルコールを製造するための暫定的な指針を示す2020年3月発行の3つのガイダンス文書を取り下げました。
COVID-19パンデミック時にハンドサニタイザーを供給するために、公衆衛生上の緊急事態下において製造を開始したメーカー以外の元々のメーカーからのアルコール系ハンドサニタイザーの供給が増加し、現在、ほとんどの消費者および医療従事者がアルコール系ハンドサニタイザーを容易に入手する事が出来るようになっています。そのため、FDAは、公衆衛生上の緊急事態以前には医薬品メーカーではなかったメーカーが、アルコール系ハンドサニタイザー、およびハンドサニタイザーに使用するアルコールを製造するための暫定的な指針を示す2020年3月発行の3つのガイダンス文書を取り下げました。
アルコール系ハンドサニタイザーおよび暫定指針に基づきアルコール系ハンドサニタイザーに使用するアルコールを製造する企業は、2021年12月31日までにこれらの製品の製造を中止している必要があります。2021年12月31日以前に製造され、暫定指針に基づき製造されたアルコール系ハンドサニタイザーは、2022年3月31日以降、販売または配布することはできません。また、製造業者は、2022年3月31日以降、アルコール系ハンドサニタイザーの最終製品を製造するために、暫定的な方針の下で製造されたエタノールを使用する事はできません。
ハンドサニタイザーの製造と販売
ハンドサニタイザーの製造を継続する予定のメーカーは、市販の局所消毒剤に関する暫定的な最終モノグラフおよびFDAの現行適正製造基準要件を含む該当要件を遵守する限り、製造を継続することが出来ます。該当要件を遵守する予定のないメーカーは、ハンドサニタイザーの登録を削除する必要があります。
また、FDAは、輸入業者、荷受人、流通業者、小売業者などに対し、たとえ製造元がリコールしていなくても、死亡の原因になりうる危険性があるとして、特定のハンドサニタイザーを流通・販売しないように勧告しています。FDAは、消費者が使用すべきでないハンドサニタイザーのリストを管理、公表しており、ハンドサニタイザーの流通や販売に関わる事業者は、定期的に更新されているこのリストを継続的に確認することを推奨しています。FDAは、リストに掲載されているすべてのハンドサニタイザーを粗悪品および/または不正品とみなしており、これらの製品を米国内で流通または販売することを連邦法で禁止しています。
2022年1月5日
遺伝子組み換え作物(GMO)の表示が購入の意思決定に与える影響について
 Industry DiveのシニアレポーターMegan Poinskiは、コーネル大学の研究結果によると、Non-GMO projectによる自主的な認証の方が、2022年1月1日より施行された強制的なBioengineering情報開示よりも消費者に大きな影響を与えているであろうと記述しています。
Industry DiveのシニアレポーターMegan Poinskiは、コーネル大学の研究結果によると、Non-GMO projectによる自主的な認証の方が、2022年1月1日より施行された強制的なBioengineering情報開示よりも消費者に大きな影響を与えているであろうと記述しています。
本年1月1日からUSDA(米国農務省)により米国で販売される食品で、遺伝子組み換えDNAが検出される原材料を使用している場合、その旨をラベルに表示する事が義務化されました。。遺伝子組み換え作物の表示は何年も前から話題になっていましたが、本研究によると、パッケージ上の開示が義務づけられたことによる消費者の新しい反応はあまりないとみられています。
コーネル大学教員のAaron Adalja氏とJura Liaukonyte氏が取り組んだこの研究は、バーモント州が独自の遺伝子組み換え表示法を制定した後、シリアル製品の販売データを調査したものです。短命に終わったこの州法は2016年7月に施行され、同年末に連邦表示法によって無効となりました。研究者の調査によると、表示法が施行されても、消費者の遺伝子組み換え作物使用製品の購入率はあまり変わりませんでした。
しかし、GMOラベルが消費者心理や購買習慣に影響を与えないというわけではありません。Adalja氏とLiaukonyte氏は、州レベルで表示法を検討した7つの州でGoogle検索を調べたところ、この問題をめぐる世論の議論の高まりにより、GMO情報やNon-GMO Project(厳しい検証プログラムを持つ独立非営利団体)への関心が高まったことがわかりました。バーモント州の購入データでは、遺伝子組み換えに関する法制化の議論に伴い、Non-GMO Project認証製品の購入がわずかに増加したことが示されています。また、この問題が取り沙汰されなくなった後も、この購買傾向はほぼ安定していす。
「本研究で観察した行動の変化は、規則制定のプロセスと、過去10年間市場で使用されているNon-GMO(project)ラベルの存在によって既に促進されていました。すなわち法律が制定される前に、多くの消費者がすでに行動を変えていたのです。」とAdalja氏は述べています。
遺伝子組み換え食品を使用した製品の表示が義務化されれば、消費者の嗜好や購買意欲が大きく変化するであろうと指摘していた過去の研究とは対照的に、今回の研究では、その影響はより緩やかであることが示されています。
また、消費者にとって最もインパクトのあるラベルは、製品が遺伝子組み換えされた原料を使用したという強制的なBioengineering開示ではなく、Non-GMO Projectによる任意の認証であることも示していると、Liaukonyte氏は述べています。
更に同氏は「GMOかNon-GMOか、ということを気にする人たちは、どの製品がGMOで、どの製品がNon-GMOか、ということを知るための情報をすでに持っています。そして、それを気にしない人々は義務的な表示によって購買行動を変えることはないでしょう。」と述べています。
意識改革=行動改革
Adalja、Liaukonyte両氏は、いくつかの州や議会で行われたGMO表示に関する議論を聞いて、実際の買い物客やウェブ検索のデータを見てみることに興味を持ちました。GMO表示の影響に関する過去の研究の多くは、消費者に商品のパッケージを見せ、選好を聞くという実験室で行われたものです。
「実験室では、常に隔離した状態でテストをしていますよね。しかし、今回、実際に起こっている事が実験結果と異なっている理由は、実際の市場には、他のすべてのシグナルが共存していたことです。GMO表示、Non-GMO表示があり、市場ではその他いろいろなことが起こっているのです。」とLiaukonyte氏は言いました。
2010年からNon-GMO projectがバタフライのシールを用いた認証を開始したこともあり、GMO製品や表示に関する認知度は高まっています。しかし一方で、遺伝子組換え食品であることをパッケージに表示することは、義務化されるまではほとんど行われていませんでした。
しかし、2013年にバーモント州のGMO表示法が導入されると、複数のシリアルメーカーが既存製品および新製品に対してNon-GMO Projectの検証を開始しました。2014年に同法律が可決され、施行される直前、研究者は新しいNon-GMO Project認証が増加していることを発見しました。最も多くの認証製品が店頭に並んだのは、バーモント州の法律が施行される数カ月前の2016年1月でした。論文によると、このとき、食料品店あたりのNon-GMO製品の平均数は29.5%増加し、少なくとも1つのNon-GMO製品を置いている店の数は39%増加しました。
また、バーモント州におけるGMO製品とNon-GMO製品の市場シェアは、2016年を通してそれぞれ約75%と12%で安定的に推移していることも研究により明らかになりました。
消費者が行動を変える動機となったのは、GMO食品に関するニュースでした。GMO食品の表示が州議会で審議され、その結果、この問題がニュースや一般的な議論に発展した州では、立法期間中にGMO食品に関するGoogle検索が急増したことが分かりました。しかし、議会が終了すると、これらの検索ワードに対する関心は低下しました。結局、これらの州におけるNon-GMO Project 認証商品の市場シェアは、この問題に対して何のアクションも起こさなかった州に比べてわずかな上昇に留まりました。
食品会社にとっては思いがけないチャンス
バーモント州のGMO表示法が施行されるまでの間、メーカーや業界団体からこの表示制度に対する反発がかなりありました。
しかし、2016年に当時のオバマ大統領が米国で販売されるすべての製品に遺伝子組み換え成分の開示を義務付ける連邦法に署名して以来、食品・飲料業界ではGMO表示はそれほど懸念されなくなりました。メーカーも快く応じており、業界内の最大の不満は、何を表示する必要があるのかのニュアンスを正しく把握することにありました。
食品ラベルコンサルティング会社Prime Label Consultantsの社長であるJesse Zuehlke氏は、ほとんどのメーカーが、過去1年間で義務付けられた情報開示を静かに実行していると述べました。法律では、簡単なテキスト、スキャン可能なQRコード、シンボル、電話番号やテキストメッセージのいずれかでの開示が義務付けられています。Zuehlke氏によると、情報開示のほとんどは、シンプルなテキストかQRコードを使用しており、これらがスペースを最小限に抑えることができる方法だといいます。
一方、より消費者の関心を集めているのが、Non-GMO project認証表示です。これは任意の情報開示ですが、製品が認証を獲得するために厳しい基準を満たす必要があります。連邦政府が要求する遺伝子組み換え成分の開示がない商品は、Non-GMO projectの認証を受ける資格がありません。しかし、このシールは消費者にGMO成分情報を効率的に伝えることができることが示されています。
Adalja氏は、Non-GMO projectの情報開示が注目されていることは、メーカーにとって大きなチャンスであると語ります。より多くのお金を払ってでもオーガニック認定されている製品を求める消費者がいるように、Non-GMO製品にも同様の行動をとる消費者の関心があるということです。
更に同氏は「遺伝子組み換え作物(GMO)の強制表示のイニシアティブは、必ずしも食品業界にとって弊害を与える規制ではなく、かえって企業が製品ポートフォリオを拡大し、マーケットシェアを獲得する機会として捉えることができます」と述べています。
2022年1月5日
FDAの報告対象食品の登録プロセスの迅速化と簡便化
FDAは、食品業界が安全でない食品をFDAに通知するために不可欠なツールであるReportable Food Registry(RFR)の過去のデータを誰でも容易に閲覧できる、公開データダッシュボードを新たに公開しました。毎年更新されるこの新しいダッシュボードにより、RFRからより適切なデータを、より迅速かつ容易に入手することができるようになりました。RFRプログラムは、州や地域のパートナーが健康への警告を発するタイミングを適切に判断し、有害な食品を市場から排除するための措置を講じ、サンプリングの割り当てなどの執行努力の対象を絞るのに役立つものと期待されています。
FDAからのデータ取得と分析をより迅速かつ容易に
新しいRFR公開データダッシュボードには、2009年から2019年までの10年間のデータが含まれており、28品目と20の食品安全ハザードがカバーされています。以前、データの公開に使用されていた過去のRFR年次報告書とは異なり、新しいダッシュボードでは、ユーザーがデータポイントを操作して、カスタマイズされた情報を収集し、特定の質問に対する答えを容易に見つけることができます。ユーザーは、選択した商品やハザード、および時間枠に基づいてグラフやチャートを作成したり、傾向を表示したりする事ができます。このダッシュボードは、FDAの全局的な業績管理システムであるFDA-TRACKプログラムの一部として提供されています。
FDAは、このダッシュボードを公開するにあたり、ユーザーが独自の分析を行えるように、ダウンロード可能な生のRFRデータセットを含めることで、データアクセスを増やすための追加措置を加えました。
RFRデータの閲覧・利用方法を近代化するにあたり、ダッシュボードは、
- 州および地域のパートナーは、その地域での懸念事項に対してサンプリングの割り当てを行う方法を決定するなど、データを利用してより良い作業計画を立てることができ、アクセスおよび透明性の向上に繋がります。
- 食品業界は、傾向について学ぶ事ができ、適正製造基準や予防的管理を追加するなどの措置により、有害な食品によるアウトブレイクや汚染を事前に防ぐことができるようになります。
- 食品システムの安全性を研究する研究者やその他業界関係者に堅牢なデータセットを提供します。
今後の計画:より迅速でシンプルなFDAへ通知方法の確立
食品業界の企業は、食品が危険である又は、死を招く可能性があることを発見した場合、電子ポータルを使用してFDAに報告する義務があります。2022年、FDAは、企業がボタンをクリックするだけで、社内業務システムや第三者のアプリケーションからRFRデータを直接ポータルにエクスポートできるようにするプロジェクトを開始する予定です。作業が完了すれば、ヒトおよび動物用食品会社は、RFRレポートをExtensible Markup Language形式(XML)の構造化電子ファイルとしてSafety Report Portalにアップロードすることができるようになります。関連するリコールデータを含む食品情報は、その後RFRとリコールプログラムの両方に関連する専門家とシステムに同時に送られることになります。このアップデートは2023年に利用可能になる予定です。
透明性とコラボレーション
これらの取り組みはいずれも、よりスマートな食品安全の新時代イニシアティブの主要目標である、より安全でデジタルを活用した食品システムの構築に向けた大きな前進です。それらはまた、透明性、効率性、そしてアメリカの食糧供給のあらゆる点からの関係者との協力へのFDAのコミットメントを表しています。さらに、業界向けの新しい報告プロセスは、食品小売業者、加工業者、技術プロバイダーが数年来表明してきたデータ接続の強化の必要性に対処するものです。この機能により、業界はより迅速にデータを提供することができ、業界とFDAの双方にとって大幅な時間の節約になるため、将来の更なる改善のためにリソースを配分することできるようになります。
関連追加情報のリンクは以下の通りです。
- FDA-TRACK: Reportable Food Registry Data Dashboard
- Reportable Food Registry for Industry
- Reportable Food Registry Annual Report
- FDA-TRACK: Food Safety Dashboards
- New Era of Smarter Food Safety
- Data Modernization Action Plan
2021年12月23日
スコンブロトキシン(ヒスタミン)生成魚介類の分解とヒスタミンについて
 米国食品医薬品局は、魚及び水産物の腐敗及びヒスタミンに関する現行のCPG Sec.540.525を改訂したCompliance Policy Guide(CPG)のドラフトを発行しています。このCPGのドラフトは、サーベイランスのサンプリングや検査で確認された腐敗やヒスタミンに関連した粗悪品にFDAが対処するためのガイダンスを提供するものです。また、このCPG案は、魚中のヒスタミンのレベルを引き下げることにより、ヒスタミン中毒に関する消費者保護を強化する事を目的としています。
米国食品医薬品局は、魚及び水産物の腐敗及びヒスタミンに関する現行のCPG Sec.540.525を改訂したCompliance Policy Guide(CPG)のドラフトを発行しています。このCPGのドラフトは、サーベイランスのサンプリングや検査で確認された腐敗やヒスタミンに関連した粗悪品にFDAが対処するためのガイダンスを提供するものです。また、このCPG案は、魚中のヒスタミンのレベルを引き下げることにより、ヒスタミン中毒に関する消費者保護を強化する事を目的としています。
マグロ、マヒマヒ、イワシなど特定のヒレ科魚類は、筋肉組織の組成のため、魚が死んだ後の腐敗によってヒスタミンが発生し、人の健康を脅かす可能性があります。死後、適切に冷却してその状態を維持するか、あるいは微生物の活動を防ぐための処理・加工を施さない限り、ヒスタミンはこれらの魚の食用筋肉に蓄積される可能性があります。いったん形成されたヒスタミンは、洗浄、冷凍、または加熱によって確実に除去することはできません。中毒は、高濃度のヒスタミンを含む食品を摂取してから数分から数時間以内に起こります。しかし、適切に収穫され、処理された場合、これらの魚からヒスタミンはほとんど検出されません。ヒスタミン中毒またはスコンブロトキシン魚中毒は、米国におけるヒレ科魚類に関連する疾病の中で最も多いものです。
FDAは、これらの魚に含まれるヒスタミンの存在について、2つのガイダンスレベルを更新しています。サンプルに35ppm以上のヒスタミンが含まれる場合(50ppmから引き下げ)、FDAはその魚が腐敗しているか不衛生な条件下で生産されているとして、粗悪品とします。また、200ppm以上のレベル(500ppmから引き下げ)では、有害物質(ヒスタミン)の存在により、FDAはその魚が人の健康を害する可能性が更に深刻であるとし、粗悪品とします。CPGは、流通経路における各加工業者が、FDAの魚介類および水産加工品の規制で要求されるcGMPおよび危害分析重要管理点(HACCP)の原則を順守することによって、魚のヒスタミン濃度の上昇を防ぐことができると指摘しています。
このドラフト文書に関するコメントや提案は、連邦官報にドラフトガイダンスの公開を告知してから60日以内に提出する必要があります。コメントのある方は以下のリンクから整理番号FDA-2021-D-0367にコメントを提出してください。
Regulations.gov
オンラインによる意見提出ができない場合は、以下向けに書面による意見提出をする事も可能です。書面による意見には、整理番号FDA-2021-D-0367と明記してください。
Dockets Management
Food and Drug Administration
5630 Fishers Lane, Rm 1061
Rockville, MD 20852
追加情報のリンクは以下の通りです。
2021年12月21日
FSMAの特定の免除対象についてのガイダンス更新
米国食品医薬品局(FDA)は、FDA食品安全近代化法(FSMA)規制とFSMA以前の規制との関連性を説明するため、FDAのジュースHACCP(危害分析重要管理点)、水産物HACCP、低酸性缶詰食品の規制対象食品メーカー向けのガイダンス文書3つを更新しました。
2017年、FDAは、FSMA以前の規制の対象となる食品の生産者が、FSMA規制のどの部分が適用され、FSMA規制が生産者の業務にどのように影響するかを理解してもらうために、ガイダンスを発表しましたが、この度それらガイダンスを更新しました。
詳細は以下のリンクをご参照ください
- Food Safety Modernization Act (FSMA)
- Guidance for Industry: Juice HACCP and the FDA Food Safety Modernization Act
- Guidance for Industry: Low-Acid Foods Packaged in Hermetically Sealed Containers (LACF) Regulation and the FDA Food Safety Modernization Act
- Guidance for Industry: Seafood HACCP and the FDA Food Safety Modernization Act
2021年9月21日
福島第一原子力発電所の事故に関するインポートアラート解除
 米国食品医薬品局(FDA)は、2011年以降、福島第一原子力発電所に隣接する県からの特定の食品を対象としてきたインポートアラート(IA)99-33を解除する事を発表しました。
米国食品医薬品局(FDA)は、2011年以降、福島第一原子力発電所に隣接する県からの特定の食品を対象としてきたインポートアラート(IA)99-33を解除する事を発表しました。
東日本大震災後、日本政府は、放射性物質の汚染による公衆衛生上のリスクを考慮して、被災した都道府県の一部の食品を食用に適さないと判断し、日本国内および輸出の両方で販売を禁止しました。これを受けて、FDAはインポートアラート(IA) "Detention Without Physical Examination of Products from Japan due to Radionuclide Contamination "を発行しました。IAの根拠は、連邦食品医薬品化粧品法第801条(a)(2)、FDA管轄下の製品が、生産された国や輸出国で販売が禁止または制限されている場合には、米国への入国を拒否することができるとするものです。
日本の除染、監視、法執行を含む強固な管理体制を徹底的に分析し、10年間にわたる日本からの食品サンプリングの結果を検討し、日本から輸入された放射能汚染食品が米国の消費者に与えるリスクは極めて低いと判断した結果、FDAはIAが公衆衛生を守るためにもはや不必要であるためIAを停止する事を決定しました。
IAが解除された後も、日本の管理措置とFDAのサーベイランスおよびサンプリング措置による複数レベルでの監視継続的に行われ、日本からの輸入食品が放射性核種の汚染により米国の消費者に食品安全上のリスクをもたらさないことを確実にすることができます。
FDAは、日本から米国に輸出される食品の安全性を監視・確保するために、2011年の震災後から継続的に日本政府と協働しています。
2021年8月29日
EPA、クロルピリホスの許容量を取り消し
 環境保護庁(EPA)は、農薬クロルピリホスの食品への使用に関するすべての許容量を取り消す旨の連邦官報公告を行う予定であることを知らせる公表前通知を以下の通り発表しました。
環境保護庁(EPA)は、農薬クロルピリホスの食品への使用に関するすべての許容量を取り消す旨の連邦官報公告を行う予定であることを知らせる公表前通知を以下の通り発表しました。
環境保護庁
40 CFR Part 180
[EPA-HQ-OPP-2021-0523; FRL-5993-04-OCSPP]
クロルピリホス;許容量の取り消し
機関:環境保護庁(EPA)
アクション:最終規則
概要:2021年4月29日、米国第9巡回区控訴裁判所は、EPAに対し、クロルピリホスの許容量に関する最終規則を2021年8月20日までに発行するよう命じた。
現在入手可能なデータに基づき、クロルピリホスの現在登録されている用途を考慮すると、EPAは、クロルピリホスの使用による総体的な暴露によるリスクが、連邦食品・医薬品・化粧品法(FFDCA)の安全基準を満たすと結論付けることができないため、EPAはクロルピリホスのすべての許容範囲を撤回する。
日付: この最終規則は[連邦官報に掲載された日から60日後の日付]に発効され、許容量の取り消しは、[連邦官報に掲載された日から6ヶ月後の日付]に有効となる。
書面による異議申し立て、聴聞請求、または訴訟識別(ID)番号 EPA-HQ-OPP-2021-0523 で特定される停止請求は、[連邦官報に掲載された日から60日後の日付] までに受理されなければならない。
詳細情報や問い合わせ先は以下の通り。
http://www.epa.gov/dockets
Pesticide Re-Evaluation Division (7508P),
Office of Pesticide Programs, Environmental Protection Agency,
1200 Pennsylvania Ave., NW., Washington, DC 20460-0001
電話番号: 703-347-0206
メールアドレス: OPPChlorpyrifosInquiries@epa.gov
2021年8月24日
全米オーガニックプログラム;許容・禁止物質の全国リスト(2022 サンセット)
 米国農務省農業マーケティング・サービス(USDA AMS)は、全米オーガニック認証基準委員会(NOSB)から農務長官に提出された勧告を実施するために、米国農務省のオーガニック規則の許容・禁止物質の全国リストのセクションの修正を提案しています。これは、オーガニック農作物生産、家畜生産、加工製品の製造において現在許可されている物質のいくつかを、全国リストから削除することを提案するものです。
米国農務省農業マーケティング・サービス(USDA AMS)は、全米オーガニック認証基準委員会(NOSB)から農務長官に提出された勧告を実施するために、米国農務省のオーガニック規則の許容・禁止物質の全国リストのセクションの修正を提案しています。これは、オーガニック農作物生産、家畜生産、加工製品の製造において現在許可されている物質のいくつかを、全国リストから削除することを提案するものです。
背景
2000年12月21日、農務長官はUSDA AMSの全国オーガニックプログラムとUSDAオーガニック規則を制定しました(65 FR 80547)。USDAオーガニック規則(7 CFR part 205)の中には、「許容・禁止物質の全国リスト」(以下、「全国リスト」)があります。全国リストは,オーガニック農作物および家畜の生産に使用できる合成物質と、使用できない非合成(天然)物質を特定しています。また、オーガニック加工製品に使用可能な非オーガニック物質も記載されています。
全国リストに掲載されるためには、以下の条件を満たす必要があります。(1)15人のメンバーからなる連邦諮問委員会であるNOSBによって5年ごとにレビューされること、(2)長官によって更新されること(7 U.S.C. 6517(e))。なお、このNOSBによるレビューとUSDAによる更新は、一般的に 「サンセットレビュー」または「サンセットプロセス」と呼ばれています。AMSはこのプロセスに関する情報を、2013年9月16日に連邦官報に掲載しました(78 FR 56811)。各物質のサンセット日(つまり、全国リストへの掲載が有効であり続けるために、長官が物質を更新しなければならない日)は、NOPプログラムハンドブック(ドキュメントNOP 5611)に記載されています。
NOSBは、サンセットレビューの過程で以下に記載されている物質が、当該物質がオーガニック栽培やその取扱いに必要でなくなった、あるいはオーガニック食品生産法(7 U.S.C. 6518)で定められた基準に適合しなくなったと判断しました。
NOSBのサンセットレビュープロセスの終了時に提出された提言に基づき、AMSは、オーガニックの農作物・家畜生産において現在許可されている以下の合成物質を削除するようリストを修正することを提案しています(7 CFR 205.601および205.603)。
- ショ糖オクタン酸エステル(作物生産)
- ビタミンB1(作物生産)
- オキシトシン(家畜生産)
- プロカイン(家畜生産)
- ショ糖オクタン酸エステル(家畜生産)
さらにAMSは、現在オーガニックの取扱いが認められている以下の非オーガニック成分を削除するようリストを修正することも提案しています(§205.605および205.606)。
- アルギン酸
- 着色料(ブラックカラント果汁色素、ブルーベリー果汁色素、ニンジン果汁色素、チェリー果汁色素、ブドウ果汁色素、パプリカ色素、カボチャ果汁色素、ウコンエキス色素)
- 昆布
- こんにゃく粉
- 片栗粉
- トルコ産ベイリーフ
- 濃縮ホエイプロテイン
これらの物質の全国リストからの削除案は、2015年10月29日、2017年11月2日、2018年10月26日、2020年10月30日に開催されたNOSBの公開会議の終了後に長官に提出された全米オーガニック認証基準委員会(NOSB)の勧告に対応するものです。
本規則案に対するコメントは、Federal Rulemaking Portal(https://www.regulations.gov/)に送ることができます。2021年10月25日以前であれば、文書番号AMS-NOP-19-0106を検索することで、本規則案とパブリックコメントの提出方法にアクセスできます。また、コメントは、以下に送ることも可能です。
Jared Clark,
Standards Division, National Organic Program, USDA-AMS-NOP,
1400 Independence Ave. SW, Room 2642-So., Ag Stop 0268,
Washington, DC 20250-0268.
AMSは、削除案そのものに関するコメントに加えて、本規則案の修正を最終化した場合に、オーガニック事業者(生産者や取扱者)が必要となる変更を実施するための期間の要・不要についてのコメントを求めています。この規則に含まれる物質・成分は、トルコ産のベイリーフと濃縮ホエイプロテイン(サンセット日は2022年6月27日)を除き、すべて2022年3月15日が「サンセット日」となっています。AMSは、オーガニック事業者が提案された変更を遵守するために、サンセット日の後にどの程度の期間が必要かについてコメントを求めています。
2021年8月11日
CBD関連:FDA、フルスペクトラムのヘンプ(麻)成分に関する2つのNDI(New Dietary Ingredient)申請を却下
 CBD業界の代表的な企業であるCharlotte's WebとIrwin Naturalsは、フルスペクトラムのヘンプエキスについてNDI(New Dietary Ingredient:新しい栄養補助食品原材料)申請を行いましたが、FDAは①医薬品除外条項と②安全性の立証に対する懸念を理由に申請を却下しました。①に関して、両社はCBD単離体ではなくフルスペクトラムのヘンプエキスについてNDI申請を行いましたが、FDAは、CBD単離体の医薬品であるEpidiolexとの法的矛盾を理由に、両社の申し立てを却下しました。②については、FDAは、NDI申請を立証するために両社が提出したエビデンス(科学的証拠)に懸念を示しました。FDAは、両社の申請を却下し、両社のフルスペクトラムのヘンプエキスを「栄養補助食品として、または栄養補助食品原材料として販売してはならない」と述べています。
CBD業界の代表的な企業であるCharlotte's WebとIrwin Naturalsは、フルスペクトラムのヘンプエキスについてNDI(New Dietary Ingredient:新しい栄養補助食品原材料)申請を行いましたが、FDAは①医薬品除外条項と②安全性の立証に対する懸念を理由に申請を却下しました。①に関して、両社はCBD単離体ではなくフルスペクトラムのヘンプエキスについてNDI申請を行いましたが、FDAは、CBD単離体の医薬品であるEpidiolexとの法的矛盾を理由に、両社の申し立てを却下しました。②については、FDAは、NDI申請を立証するために両社が提出したエビデンス(科学的証拠)に懸念を示しました。FDAは、両社の申請を却下し、両社のフルスペクトラムのヘンプエキスを「栄養補助食品として、または栄養補助食品原材料として販売してはならない」と述べています。
両申請却下において、FDAはまず、食品・医薬品・化粧品法のIND(Investigational New Drug=治験薬)除外規定を引用し、医薬品として最初に研究されたものは、栄養補助食品として販売することはできない事を理由としています。
FDAは除外条項を適用し、栄養補助食品原材料としてCBD単離成分だけでなく、フルスペクトラムヘンプ全体の使用にも異議を唱えていることが明らかになりました。フルスペクトラムのヘンプは、CBDだけでなく、エッセンシャルオイル、テルペン、その他のカンナビノイドなど、大麻植物の他の成分も含んでいます。
申請した両社は、フルスペクトラムのヘンプエキスはCBD単離物とは別物であり、同法のIND(治験薬)除外はフルスペクトルのヘンプエキスには適用されないと主張しています。
Charlotte's WebとIrwin Naturalsに対するFDA申請の却下において、「FDAは、CBD製品が21 U.S.C. §321(ff)(3)(B)(同法201(ff)(3)(B)項)に基づく栄養補助食品の定義から除外されると結論付けました。CBDは、承認された医薬品であるEpidiolexの有効成分です。さらに、CBDを含む実質的な臨床研究の存在が公表されています。また、FDAは、CBDが新薬としての調査を認可される前に、栄養補助食品や従来の食品として販売されていなかったと判断しています。」と書かれています。
Irwin Naturalsの書簡では、FDAはさらに、記録に基づき、FDAはNDI 1199が一貫したレベルのCBDを確保するように設計されていること、相当量のCBDを含むヘンプ植物から製造されていること、製造プロセスにより、医薬品に匹敵する比較的多い量のCBDを1日あたり供給する製品としていること、現在販売されている製品を見ると、同社は「フルスペクトラムヘンプエキス」を含む製品をCBD製品として販売していることが明らかであるとしています。総合的に見て、FDAは同社のNDI 1199はCBD製品であり、したがって栄養補助食品の定義からの除外の対象になるという結論を出しています。
また、FDAからの申請却下理由として、NDI申請に同社が記載した安全性データが不十分であると記載されています。
同業界関係者は、これらのFDAの発言に失望と不満を示しており、FDAがこれらのNDI申請却下で、ヘンプエキスにIND除外条項を完全に適用することを明らかにした今となっては、CBDを栄養補助食品として合法化するための唯一の道筋は、CBDを栄養補助食品として合法化する事を議会で立法するしかないと述べています。
すでに議会では、"The Hemp and Hemp-Derived CBD Consumer Protection and Market Stabilization Act of 2021"(H.R.841)や"Hemp Access and Consumer Safety Act"(S.1698)などの法案が提出されています。7月には、上院院内総務のChuck Schumer氏(民主党・NY州)が別の法案の草案を主導していることも発表されました。
<注>
NDI: New Dietary Ingredient(新栄養補助食品・原材料の申請)
IND: Investigational New Drug(治験薬)
2021年6月9日
FDA、ヨーグルトのアイデンティに係る基準を改定
 米国食品医薬品局(FDA)は、ヨーグルトの製造における柔軟性と技術的進歩を可能にするために、ヨーグルトのアイデンティティに係る基準を修正し、近代化するための最終規則を発行しました。
米国食品医薬品局(FDA)は、ヨーグルトの製造における柔軟性と技術的進歩を可能にするために、ヨーグルトのアイデンティティに係る基準を修正し、近代化するための最終規則を発行しました。
この取り組みは、FDAの栄養革新戦略の一環です。アイデンティティに関する基準は、特定の食品の中身や製造に関する要件を定めたものです。栄養革新戦略の目標の一つは、食品の基本的な性質と栄養学的な完全性を維持するために食品基準を近代化し、より健康的な食品を生産する技術の革新ができるように業界に柔軟性を与えることです。FDAは、誠実で公正な取引を促進するため、1938年頃からアイデンティティの基準を設け始め、それ以来、280以上の基準を多種多様な食品に対して設けてきました。
現在、FDAはヨーグルト、低脂肪ヨーグルト、無脂肪ヨーグルトのアイデンティティの基準を別々に定めていますが、最終規則では、低脂肪ヨーグルトと無脂肪ヨーグルトは、FDAの一般的な定義とアイデンティティの基準の対象となり、従来の標準化された食品に栄養学的な修正を加えたものが認められます。
具体的には、アガベなどの甘味料や、基本的な乳成分を再構成したものなど、ヨーグルトに使用できる原材料を拡大しており、またヨーグルトに「生きた活性菌を含む」などの任意の表示をする際に必要な、生きた活性菌の最低含有量を定めています。生きた活性菌を不活性化する処理を施したヨーグルトについては、「生きた活性菌を含みません」という表示が必要になります。さらに、最終規則では、ヨーグルト市場ですでに行われている多くの技術革新を支持しています。例えば、栄養強化の要件を満たしている限り、ビタミンAやDの添加による栄養強化を引き続き認めています。また、同規則では、アイデンティ基準の要件を満たしている限り、様々なスタイルや食感のヨーグルトも認めています。
この措置は、National Yogurt Association(現在はInternational Dairy Foods Associationの一部)が提出した市民請願に一部対応したもので、この最終規則の遵守日は2024年1月1日です。
2021年4月26日
ゴマのアレルギー表示義務化
 2004年食品アレルゲン表示・消費者保護法(FALCPA)の制定以降、「主要な食品アレルゲン」を含む原材料を含む食品のラベルには、同法に記載された方法でアレルゲンの存在を表示する事が求められています。同法が定める8つの主要な食物アレルゲン(牛乳、卵、魚、甲殻類、木の実、小麦、ピーナッツ、大豆)は特別な食物アレルギー表示の対象として指定されておりが米国で記録されている食物アレルギーの90%以上を占め、重篤な反応や生命を脅かす反応を引き起こす可能性が最も高い食品を代表するものです。
2004年食品アレルゲン表示・消費者保護法(FALCPA)の制定以降、「主要な食品アレルゲン」を含む原材料を含む食品のラベルには、同法に記載された方法でアレルゲンの存在を表示する事が求められています。同法が定める8つの主要な食物アレルゲン(牛乳、卵、魚、甲殻類、木の実、小麦、ピーナッツ、大豆)は特別な食物アレルギー表示の対象として指定されておりが米国で記録されている食物アレルギーの90%以上を占め、重篤な反応や生命を脅かす反応を引き起こす可能性が最も高い食品を代表するものです。
2021年4月23日、バイデン大統領は「食品アレルギー安全・処置・教育および調査に関する法律:Food Allergy Safety, Treatment, Education and Research (FASTER)法」に署名し、ゴマをラベル表示を必要とする9番目のアレルゲンとしました。 この変更は、2023年1月1日以降に流通が開始されるすべてのゴマ含有食品に適用されます。また、新法では、FDAが蔓延している食物アレルギーに関するデータを収集、効果的な食物アレルギー診断法の開発、食物アレルギーの予防、食品または食品成分を 「主要な食物アレルゲン」と定義するための科学的基準について、議会への報告書を作成することを義務付けています。FDAは、スパイスやフレーバーなどの添加物を含め主要な食物アレルゲン以外のアレルゲンであるもの、あるいはアレルゲンが含まれているものについて開示を求める規制を発行する権限を有しています。2014年11月に、ゴマを他の主要なアレルゲンと同様に規制することを求める市民請願が提出されていましたが、FDAは、アレルゲンとしてゴマをラベル表示する事に対して自主的な開示に関するガイダンスを昨年末に発行した事にとどまっていました。
Eureka Global Solutions FDA関連ニュース 2020年11月10日、FDA、“食品ラベルの原材料リストでゴマの使用を明確にすることを食品メーカーに奨励”をご参照ください。
消費者団体は、2021年のFASTER法が、次にアレルギーが重度なものであり米国内で蔓延していることが明らかになったときに、「主要な食品アレルゲン」のリストを迅速に加える事ができるようになる事を期待しています。 Food Allergy Research & Education (FARE)という団体の回答によると、160万人近くのアメリカ人がゴマに対してアレルギーを持っており、食品ラベルに記載されることによって、ゴマを誤って摂取することによる死亡リスクが低くなる事が期待されます。
FDAは、2020年11月10日に、食品メーカーに対し、原材料にゴマが含まれる場合はラベルの原材料リストにゴマを自主的に表示するよう促すガイダンス案を出していますが、FASTER法が通った後、現時点でもゴマのアレルゲン表示義務化についてのガイダンスを公表していません。
2021年4月8日
FDA、乳幼児向け食品からの有害物質への曝露を低減するためのアクションプランを発表
 米国食品医薬品局(FDA)は、最も脆弱なカテゴリーとみられる乳幼児を保護することを最優先事項の一つとしており、4月8日に新たなアクションプラン「Closer to Zero(ゼロにより近づける)」を発表しました。これは、乳幼児がよく食する食品に含まれる有害物質を、可能な限り低いレベルに抑えるためのFDAのアプローチを定めたものです。FDAのテストにより現状食品に含まれているレベルの有害物質の量は、子どもたちの健康を直ちに害するようなレベルがではないという事が分かっていますが、FDAは、これらの食品に含まれる有害物質のレベルを、時間をかけて継続的に低下させるという短期的および長期的な目標を掲げて、直ちに計画作業に着手しています。
米国食品医薬品局(FDA)は、最も脆弱なカテゴリーとみられる乳幼児を保護することを最優先事項の一つとしており、4月8日に新たなアクションプラン「Closer to Zero(ゼロにより近づける)」を発表しました。これは、乳幼児がよく食する食品に含まれる有害物質を、可能な限り低いレベルに抑えるためのFDAのアプローチを定めたものです。FDAのテストにより現状食品に含まれているレベルの有害物質の量は、子どもたちの健康を直ちに害するようなレベルがではないという事が分かっていますが、FDAは、これらの食品に含まれる有害物質のレベルを、時間をかけて継続的に低下させるという短期的および長期的な目標を掲げて、直ちに計画作業に着手しています。
米国人は、自分たちの乳幼児が口にする食品に有害物質が全く含まれていないことを望んでいますが実際には、これらの有害物質は空気中、水、土壌に含まれているため、これらのレベルを低くするにはある程度の限界があります。そのため、FDAの目標は、これらの食品に含まれるヒ素、鉛、カドミウム、水銀のレベルを可能な限り下げることにあります。また、現在実現不可能なレベルを一度に製造会社に要求すれば、多くの家族が子供に必要な栄養価の高い、手頃な価格の食品を入手することが大変困難になる可能性があることも考慮しています。そのため、FDAの計画では、食品中の有害物質のレベルを徐々にゼロに近づけていくという目標を達成させるために、科学的根拠に基づいた複数段階の反復的なアプローチを採用しています。
Closer to Zeroでは、有害物質に関する食生活の変化を調査・評価し、アクションレベル(業界が達成可能な食品中の有害物質の推奨限界値で、必要に応じて段階的にそのレベルを引き下げていく)を設定し、産業界によるベストプラクティスの採用を推奨し、進捗状況をモニタリングしていきます。
同アクションプランは、3つのフェーズで構成されていますが、第1段階では、以下の4つのアプローチを用いてアクションレベルの設定作業を直ちに開始します。
1. アクションレベルの科学的根拠を評価する
継続的な改善のサイクルは、食品供給に関する日常的な検査、化学分析方法、毒物学的分析手順、曝露量およびリスク評価、その他の関連する科学的情報の研究とデータから、既存のデータを評価することから始まります。諮問委員会、公開ワークショップ、科学専門家、連邦政府機関パートナー、その他の利害関係者との協議を含むプロセスを経て、FDAは必要に応じて特定の有害物質の暫定基準値(IRL)を設定します。IRLは、食品からの曝露量を示す指標であり、FDAは、食品中の個々の物質からの曝露量が特定の健康への影響をもたらすかどうかを判断するために使用することができます。
2. アクションレベルの提案
ベビーフード(シリアル、粉ミルク、ピューレ状の果物や野菜など)やその他乳幼児がよく食べる食品に含まれる特定の有害物質のFDAのアクションレベルの策定において、IRLが重要な要素の一つとなる可能性があります。
3. アクションレベルの達成可能性と実現可能性を含む、アクションレベルについての利害関係者との協議
FDAは、特定された食品のカテゴリーごとに、毒性要素ごとに、ワークショップや科学会議、連邦政府のパートナーとの協力を含む協議のプロセスを通じてデータやその他の情報を収集し、提案されたアクションレベルの達成可能性と実現可能性、およびそれらに到達するためのタイムフレームなどを評価します。
4. アクションレベルの最終決定
FDAは、利害関係者から収集した情報、最新の科学研究結果、および定期的なモニタリングデータを使用して、必要に応じて調整を行い、アクションレベルを確定します。
FDAは最終的なアクションレベルを発表した後、アクションレベル達成に向けた業界の進捗状況を評価するための期間を設定し、アクションレベルをさらに下方修正する努力を科学的データが裏付けるかどうかを判断するためのサイクルを再開します。
FDAは、食品中の有害物質への曝露量を制限することが、意図しない結果を招かないようにするための対策も講じます。例えば、栄養面で大きなメリットのある食品が多くの家庭で入手しにくくなったり、ある有害物質の含有量を減らすために食品を改良した際に、意図せずに他の有害元素の含有量が増えてしまったりすることがないようにします。さらに、ゼロに近づけるという目標は、果物、野菜、穀物が成長する過程で環境中の有害物質を取り込んでいるという現実を反映しています。継続的な改善と協力のサイクルにより、これらの食品に含まれる有害物質の量を、時間をかけて限りなくゼロに近づけていくことを目指しています。
ご参考:
- 現在のところ、FDAがベビーフードに含まれる重金属のアクションレベルを設定しているのは、乳児用ライスシリアルに対する100ppbの無機ヒ素の基準のみです。詳細はこちらをご確認ください。
- 2021年2月には米国下院より発表されたBaby Foods Are Tainted with Dangerous Levels of Arsenic, Lead, Cadmium, and Mercury(離乳食は危険なレベルのヒ素、鉛、カドミウム、および水銀により汚染されている)のリンクはこちらをご参照ください。
- ベビーフードに含まれる重金属に関する訴訟は2021年6月10付け86件にのぼります。詳細はこちらをご確認ください。
2021年4月6日
葉物野菜の安全性を高めるための2つの重要な対策
 米国食品医薬品局(FDA)は、葉物野菜の安全性を進めるために2つの重要な対策を講じています。1つ目は、葉物野菜を原因とする2020年秋に発生した大腸菌O157:H7感染症の調査報告書の公開です。この報告書では、調査で得られた知見に加えて、2017年以降、毎年秋に発生しているカリフォルニア州セントラルコーストの栽培地域に関連した葉菜類の食中毒アウトブレイクを理解する上で重要な傾向が記載されています。それに加えて、FDAは、「Leafy Green Shiga-toxin producing E. coli (STEC) Action Plan(STEC:志賀毒素産生大腸菌)」の最新版を公表し、葉物野菜の安全性を向上させるために協働していくことの重要性を強調しています。
米国食品医薬品局(FDA)は、葉物野菜の安全性を進めるために2つの重要な対策を講じています。1つ目は、葉物野菜を原因とする2020年秋に発生した大腸菌O157:H7感染症の調査報告書の公開です。この報告書では、調査で得られた知見に加えて、2017年以降、毎年秋に発生しているカリフォルニア州セントラルコーストの栽培地域に関連した葉菜類の食中毒アウトブレイクを理解する上で重要な傾向が記載されています。それに加えて、FDAは、「Leafy Green Shiga-toxin producing E. coli (STEC) Action Plan(STEC:志賀毒素産生大腸菌)」の最新版を公表し、葉物野菜の安全性を向上させるために協働していくことの重要性を強調しています。
調査レポート
2020年8月から12月にかけて、FDAと複数の州および連邦政府のパートナーが、葉物野菜の摂取が原因とみられる大腸菌O157:H7による食中毒のアウトブレイクの調査に関与しました。このアウトブレイクは、19の州で40件の疾病を引き起こし、腎不全の一種である溶血性尿毒症症候群(HUS)の4件を含む20件の入院の原因となりました。
本調査により、2020年の秋のアウトブレイクが2017年以降、毎年秋に発生しているカリフォルニア州セントラルコーストの栽培地域で栽培された葉物野菜関連のアウトブレイクと関係している事が全ゲノム配列(WGS)を介して分かりました。 調査で得られた情報と、過去のアウトブレイクに対応して収集したデータを用いて、FDAはカリフォルニア州のサリナスバレー(Salinas Valley)の栽培地域の畑に原因があると絞ることができました。FDAはカリフォルニア州のパートナーと協力して、この調査で繋がった畑を持つ複数の農場を調査しました。その結果、対象の複数の畑を持つ農場から約1.3マイル(約2km)坂を上った道路沿いで採取された牛の糞の複合サンプル1つから、今回のアウトブレイク株を確認しました。また、その他のサンプルからも大腸菌O157:H7を含む他のSTEC株が検出されました。 直接的な汚染源や汚染経路は特定されませんでしたが、今回の調査により、隣接する土地での家畜の養育など、潜在的な汚染源についての知見が得られました。
再発アウトブレイク株、生育地域、隣接する土地への潜在的な影響への懸念
FDAは、今回の調査結果を踏まえて、2017年以降、毎年秋に発生していたアウトブレイクを分析した結果、近年の大腸菌O157:H7による葉菜類の汚染の傾向として、再発性のある菌株、再発地域、隣接する土地の潜在的な影響に対する再発の懸念という3つの重要な傾向を見出しました。この病原性大腸菌の再発は、カリフォルニア州セントラルコーストの葉物野菜栽培地域において、合理的に予見可能なハザードであり、特にサリナスバレーの栽培地域であるサウスモントレー郡の地域からの葉物野菜が懸念されます。FSMA農産物安全規則の対象となる農場は、既知または合理的に予見可能なハザードに汚染されている可能性のある農産物を特定し、収穫しないための合理的に必要なあらゆる手段を講じることが求められます。
推奨事項
FDAは、カリフォルニア州セントラルコーストの栽培地域の農業関係者に対し、この病原性大腸菌の再発生株がどこに存続しているか、またSTECによる葉物野菜の汚染経路を特定する事を推奨しています。この報告書の中でFDAは、カリフォルニア州セントラルコーストの栽培地域の農業関係者に対して、カリフォルニア縦断調査や、地元主導の、カリフォルニア・アグリカルチャー・ネイバーズ(CAN)ワークグループへの参加を促しています。また、微生物学的調査、プレハーベストまたはポストハーベスト検査によって病原体が特定された場合、農業関係者は業界主導の根本原因分析を実施し、汚染がどのように発生した可能性が高いかを判断した上で、適切な防止策と検証策を実施することを推奨しています。
葉物野菜のSTECアクションプラン
FDAは、葉物野菜のSTECアクションプランに示されたビジョンを進めるために、すべての葉物野菜の関係者によるさらなる取り組みが必要であると認識しています。当初、2020年3月に発表されたこのアクションプランは、STECによる葉物野菜のアウトブレイクを防ぐために、より緊急で協力的なアプローチを促進することを目的としていました。これまでの進展としては、カリフォルニア縦断調査の開始、収穫前の農業用水に使用する抗菌処理剤使用に関する開発や登録を支援するための有効性プロトコールの開発、葉物野菜のトレーサビリティーを進めるための重点的な検査、追跡調査、サンプリング実施などが挙げられます。
この作業を踏まえて、FDAは葉物野菜の安全性を前進させるためのコミットメントの重要性を強調した、葉物野菜STECアクションプランの更新版を発表しました。更新された計画では、隣接する土地での活動に起因する汚染を防止するためのアクションの重要性を改めて強調し、2020年の成果とここで得た知見を基にした新しいアクションを発表し、COVID-19パンデミックによる課題のために2020年に達成できなかった特定のアクションを完了するというコミットメントを再確認しています。
責任の共有
FDAは、葉菜類の汚染問題を自分たちだけで解決できないことを知っています。人、動物、植物、そしてそれらが共有する環境が相互に関連していることを認識した上で、FDAは、農産物の汚染の原因となっている問題に対処するためのコラボレーションを強く推奨しています。業界がリーダーシップを発揮し、生産者、加工業者、小売業者、州のパートナー、そしてより広範な農業コミュニティが協力し、必要な予防策を確立する事が食中毒を防ぐために不可欠です。
2021年3月16日
FDA、食品安全と栄養に関する調査結果を発表
 FDAは、食品安全と栄養に関する消費者の意識、知識、理解度、そして行動を評価することを目的とした食品安全と栄養に関する調査(Food Safety and Nutrition Survey (FSANS))の最新の結果を公表しました。この調査結果は、FDAが公衆衛生を促進し保護するための規制、政策、教育、その他のリスク管理に関する情報を提供するために役立てられます。
FDAは、食品安全と栄養に関する消費者の意識、知識、理解度、そして行動を評価することを目的とした食品安全と栄養に関する調査(Food Safety and Nutrition Survey (FSANS))の最新の結果を公表しました。この調査結果は、FDAが公衆衛生を促進し保護するための規制、政策、教育、その他のリスク管理に関する情報を提供するために役立てられます。
本調査は、前回2016年に実施した食品安全調査と、2014年に実施した健康と食事に関する調査という2つの調査を統合したもので 2019年10月から11月に収集された約4,400件の回答が含まれています。
主要なポイントは以下のとおりです。
・ほとんどの消費者は、栄養成分表示についてよく知っており活用しています。
回答者の87%が食品パッケージの栄養成分表示を見たことがあります。消費者がラベルで注目する上位4項目は、カロリー、総砂糖分、ナトリウム、1食分の量です。消費者が栄養成分表示を見る主な目的は、「カロリー、塩分、ビタミン、脂肪などの含有量を知る」ため、「食品の栄養成分の概要について把握」、「異なる食品の比較」と回答しています。
・ほとんどの消費者がレストランでメニュー表示を見たことがあります。
ほとんどの回答者(70%)が、メニューやメニューボードでカロリー情報を見たことがあると答えており、その中の53%の人がカロリー情報を利用したと回答しています。高カロリーのメニューの注文を避けるために利用したと答えた人が最も多くなりました。
・消費者はパッケージ前面の表示を良く見ています。
80%以上の回答者が、「砂糖無添加」、「全粒粉」、「オーガニック」、「グルテンフリー」、「低脂肪」、「人工成分無添加」、「低糖」、「人工着色料無添加」などの表示を見たことがあるという結果でした。
・手洗いの習慣は場面によって異なります。
消費者の石鹸を使っての手洗いの習慣は、生肉を触った後(76%)、料理を作る前(68%)、生卵を割った後(39%)という結果でした。
・大半の消費者が食品温度計を所有していますが、調理内容によって使用方法が異なります。
回答者の62%が食品温度計を所有していると回答しました。食品温度計を所有していて食品を調理している人の使用率は、鶏の丸焼き85%、牛・ラム・豚のロースト79%、鶏の部位40%、ハンバーガー36%、卵料理23%、冷凍食品20%となっています。
CFSAN(FDAの食品安全・応用栄養センター)による消費者行動調査についての詳細はこちらをご覧ください。
2021年2月5日
FDA、新鮮なハーブ、グアカモーレ、加工アボカドをサンプリング
 2021年1月12日時点で、FDAは新鮮なハーブのサンプリングを再開しており、輸入されたシラントロとパセリのサンプルを収集する予定です。同サンプリングはCOVID-19の影響で一時停止していましたが、今春には完了する見込みです。ハーブサンプルの収集と分析の終了後、その結果を最終報告書として発表する予定です。
2021年1月12日時点で、FDAは新鮮なハーブのサンプリングを再開しており、輸入されたシラントロとパセリのサンプルを収集する予定です。同サンプリングはCOVID-19の影響で一時停止していましたが、今春には完了する見込みです。ハーブサンプルの収集と分析の終了後、その結果を最終報告書として発表する予定です。
なお、加工アボカドとグアカモーレのサンプリング業務は2019年度末にすでに完了しています。結果の分析は完了次第、最終報告書として公表される予定です。
詳細については、微生物監視サンプリング:FY18-21フレッシュハーブ(シラントロ、バジル、パセリ)および加工アボカドとグアカモーレを参照してください。
2020年10月9日
2020年3月31日時点で、FDAは1,272の新鮮なハーブ(国内759、輸入513)を収集し、検査しました。今回、1,600の新鮮なハーブ(国内761、輸入839)を採取する予定です。
新鮮なハーブのサンプルのうち、15がサルモネラ菌陽性(国内6、輸入9)、10が志賀毒素産生性大腸菌(STEC)陽性(国内5、輸入5)でした。さらなる調査の結果、国内のSTEC陽性となった5サンプルのうち病原性を有するのは1サンプルのみであり、その他は重篤な疾患を引き起こす可能性はないことが判明しました。また、新鮮なハーブのサンプルから大腸菌O157:H7は検出されませんでした。2018年7月、FDAは、サイクロスポラ関連の病気が一般的に夏に発生することを考慮して、新鮮なハーブのサンプルのサイクロスポラの検査も開始しました。FDAは、検査した691の新鮮なハーブサンプルのうち17(国内5、輸入12)でサイクロスポラを検出しました。
現在行われているフレッシュハーブのサンプリングは、COVID-19の影響でほとんどの監視サンプリング作業を継続することが一時的に不可能となり一時停止状態にあります。安全が確保された時点で再開し、調査終了後にデータの分析と最終報告書が公表される予定です。
FDAは、2019年度の終わりにアボカドとグアカモーレの加工サンプルの収集を終了しました。FDAは最近、加工されたアボカドとグアカモーレのサンプルの分析を開始しており、その結果は最終報告書として公表される予定です。
2021年2月19日
FDA、うつ病やその他の精神疾患を治療するというクレームの栄養補助食品を販売している10社に対し警告書発行
 2月19日、FDAは、うつ病などの精神疾患を治癒、治療、緩和、予防するというクレームの栄養補助食品を販売していた10社に対し連邦食品医薬品化粧品法(FD&C法)に違反しているとして警告書を発行したことを発表しました。警告書が発行されたのは Enlifta LLC、Lifted Naturals、Mountain Peak Nutritionals、SANA Group LLC.、Wholesome Wellness、Dr. Garber's Natural Solutions、ProHealth Inc.、Blossom Nature LLC、FDC Nutrition Inc.およびSilver Star Brands, Incです。
2月19日、FDAは、うつ病などの精神疾患を治癒、治療、緩和、予防するというクレームの栄養補助食品を販売していた10社に対し連邦食品医薬品化粧品法(FD&C法)に違反しているとして警告書を発行したことを発表しました。警告書が発行されたのは Enlifta LLC、Lifted Naturals、Mountain Peak Nutritionals、SANA Group LLC.、Wholesome Wellness、Dr. Garber's Natural Solutions、ProHealth Inc.、Blossom Nature LLC、FDC Nutrition Inc.およびSilver Star Brands, Incです。
FDAの食品安全・応用栄養センターの栄養補助食品プログラムのディレクターであるSteven Tave氏は、「うつ病やその他の精神疾患を治癒、治療、軽減、予防することを謳うクレームの栄養補助食品は、“未承認の新薬”であり、消費者が資格のある医療関係者による実証済みの治療を受けずにこれらの製品を使用した場合、危害を与える可能性があります。消費者がうつ病やメンタルヘルスの問題に非常に敏感になっている現在のパンデミックの最中には、特に注意が必要です。FDAは、違法な栄養補助食品から国民を守るための行動を取ることに尽力しています。」と述べています。
FD&C法では、疾病の治癒、治療、緩和、予防を目的とした製品は医薬品であり、たとえ栄養補助食品と表示されていても、医薬品に適用される規制に従うことが義務付けられています。FDAが承認した医薬品とは異なり、今回発表された警告書の対象となっている未承認製品が、意図した用途に有効であるかどうか、適切な投与量はどのくらいか、FDAが承認した医薬品やその他の物質とどのように相互作用するか、危険な副作用やその他の安全性の懸念がないかなどについて、FDAによる評価がされていません。
消費者は、病気を予防、治療、軽減、または治癒するという実証のないクレームがされている製品がオンラインで販売されている事に注意する必要があります。FDAは、栄養補助食品や医薬品の購入または使用を決定する前に、医師、薬剤師、またはその他の医療専門家に相談することを消費者に勧めています。例えば、栄養補助食品の中には、薬や他の栄養補助食品と相互作用するものがあります。また、クレームがあまりにも良すぎて真実ではないように聞こえる場合は、特に気を付ける必要があります。
製品が反応や病気を引き起こした可能性があると消費者が考えた場合は、直ちに製品の使用を中止し、医師に連絡する必要があります。また、FDAは、医師および消費者に対し、FDAが規制する製品に関連する副作用をMedWatchまたはSafety Reporting Portalを通じてFDAに報告することを推奨しています。
FDAは、上記の10社に対し、15営業日以内に、この問題にどのように対処するか、あるいは製品が法律に違反していないと考えられる理由と裏付け情報を提供するよう、各社に回答を求めています。速やかに違反を是正しない場合は、製品の差し押さえや差し止めを含む法的措置がとられる可能性があります。
2021年1月29日
FDA、2020年度の検査違反トップ10を公表
 米国食品医薬品局(FDA)は、2020年度の年次査察観察データを発表しました。このデータは、2019年10月から2020年9月の間に、FDAの食品施設査察で特定の違反がどのくらいの頻度で検出されたかを示しています。2020年度にFDA査察官が指摘した違反のトップ10は以下の表のとおりです。
米国食品医薬品局(FDA)は、2020年度の年次査察観察データを発表しました。このデータは、2019年10月から2020年9月の間に、FDAの食品施設査察で特定の違反がどのくらいの頻度で検出されたかを示しています。2020年度にFDA査察官が指摘した違反のトップ10は以下の表のとおりです。
1. FSVP策定
食品安全近代化法(FSMA)に基づき、FDAはほとんどの食品輸入業者に対し、サプライヤーのための外国供給者検証プログラム(FSVP)を作成し、維持することを義務付けています。この要件は、サプライヤーがFDAに準拠し、安全な方法で商品を生産していることを保証するのに役立ちます。
FSVP査察の際、FDAは輸入業者がサプライヤーの食品安全を保証する完全なFSVPを提示できることを要求しています。2020年度、FDAはFSVPを策定していないとして514施設を違反対象として挙げました。COVID-19パンデミックの影響で2020年の大半の食品施設査察が中止されましたが、FDAは引き続きFSVP査察を遠隔で実施し、FSVPの違反件数は2019年から51%増加しました。FSVPを策定していないことが査察違反の中で最多となったのは、今回で3年連続です。
2. ハザード分析
FDAは、施設が適切なハザード分析を行っていないとして104件指摘しました。FDAは、ほとんどの食品施設に、施設で発生する可能性のある潜在的な生物学的、化学的、または物理的なハザードを特定し、それらのハザードの予防管理を確立することを求めています。これは、FDAが施設が食品安全プロトコールを維持していることを確認する方法の一つです。
ハザードは多岐に亘り、例えば、病原体の除去を目的とした処理を行っても、病原体が生き残る可能性があるリスクを施設が特定する、あるいは、施設は、機器の洗浄が不十分なためにアレルゲンとの交差接触(cross-contact)が発生する可能性のあるエリアを特定することなどができます。
3. 有害生物防除(ペストコントロール)
施設査察の際、FDAは潜在的な有害生物蔓延の兆候を探します。FDAは、食品施設内の有害生物を防止していない、または食品汚染の可能性がある方法で農薬を誤用しているとして、98施設を挙げました。
4. 製造管理
製造、加工、梱包、および保管の管理における問題が発覚した施設は、95件ありました。これは、施設が、潜在的な微生物の増殖、アレルゲンの交差汚染、または食品の汚染と劣化の可能性を最小限に抑えるような条件下でオペレーションを行っていなかったことによるものです。FDAは、消費者への潜在的な健康リスクを回避するために、食品を取り扱う際に管理された適切な環境にある事を施設に求めています。
5. 人員
2020年度の査察で5番目に多く指摘された違反は、従業員に関する衛生問題やその他の適正製造基準に対処していないことが含まれます。FDAはこの違反に対して87件の施設に指摘を行いました。
6. 衛生モニタリング
FDAは81の施設に対し衛生モニタリングに問題があるとしています。これは氷の製造に使用する水を含む食品または食品接触面に接触する水の安全性、食品接触面の状態および清潔さ、不衛生な物体からの二次汚染の防止、手洗い、手指消毒、およびトイレの設備の維持、食品、食品包装材、および食品接触面の不純物混入の防止、有害化学物質の適切な表示、保管、従業員の健康状態の管理、有害生物の排除を含む現行の適正製造基準への適合を保証するのに十分な頻度で衛生状態および慣行を監視していない、という内容です。
7. 衛生に係るオペレーション – 施設管理
FDAは80の施設に対し、工場のメンテナンスと衛生の問題があると指摘しました。これらは、清潔で衛生的な食品施設の維持を怠った結果であり、食品に対する環境上の脅威にもなり得ます。これは工場の建物、備品、その他の物理的施設は、清潔で衛生的な状態に維持されなければならず、また、食品の混入を防ぐのに十分な修理が行われなければならない。器具および機器の清掃および消毒は、アレルゲンの相互接触や、食品、食品接触面、または食品包装材の汚染を防ぐ方法で行わなければならない、という内容です。
8. 工場建設や設計
FDAは工場が、メンテナンスや衛生的な運用を容易にするために建設や設計がされていなかったとして71施設が問題があるとして挙げています。
9. 設備・機器 - 設計とメンテナンス
FDAは設備や器具が、アレルゲンの相互接触、汚染から保護するために、十分な洗浄やメンテナンスができるように設計・構築されていなかったとして70施設に問題があったとしています。
10. HACCP計画の実施
HACCPプランに記載されているモニタリング、記録管理、検証手順を実施しなかったとしてFDAは73の施設に対して指摘しています。すべての加工業者は、ハザード分析により、発生する可能性が合理的に高い1つ以上の食品安全ハザードが明らかになった場合には、書面によるHACCP計画を作成し、実施しなければならない事が守られていないため、指摘されました。
2021年度に向けた準備
FSVP違反は大幅に増加しましたが、その他の上位の違反は、2020年度は2019年度に比べて減少しました。これは、COVID-19の結果、2020年は多くの食品施設への査察が一時的に延期された事が要因とみられます。
Eureka Global Solutionsは、FSVPや製造施設へのFDAによる指摘を回避するサポートを致します。今後のFDA査察に向けて準備ができているか不安な場合には、ご連絡ください。弊社の食品安全の専門家が、FDA査察を問題無くパスするためには何をすべきか、アドバイスを提供致します。
2020年12月17日
食品安全強化法(FSMA)に基づく食品トレーサビリティ規則案に関するアップデート
 2020年10月発行の弊社FDA関連ニュースで、FDAは食品トレーサビリティ記録の追加要件について検討しているという記事をご案内させて頂きましたが、その後アップデートの情報がございますのでお知らせ致します。
2020年10月発行の弊社FDA関連ニュースで、FDAは食品トレーサビリティ記録の追加要件について検討しているという記事をご案内させて頂きましたが、その後アップデートの情報がございますのでお知らせ致します。
パブリックコメントの期間延長
提案された規則案へのパブリックコメントと情報収集の期限が、当初予定の2020年12月2日から2021年2月22日まで延長となりました。
食品トレーサビリティリスト(FTL=Food Traceability List)更新・変更に関するプロセス
提案された規則は、FDAが食品トレーサビリティリストを更新・変更するためのプロセスを規定しています。 そのプロセスの下では、まず、FDAはリストの変更案と変更の理由を記載し、変更案に関する情報や見解を要求する通知を連邦官報に公開します。 これに対して提出された情報や見解を検討した後、FDAは、2回目の通知を連邦官報に公開し、変更が行われるかどうか、およびその決定の理由を公開します。 リストへの追加は、特に明記されていない限り、2回目の連邦官報通知の日付から1年後に有効になります。一方、 リストからの削除については連邦官報に公開後、すぐに有効となります。
主要な特徴
1.クリティカルトラッキングイベント(CTE)
提案されている規則では、主要データ要素(KDE) を含む記録が必要となる CTE として、作物生育、受入れ、加工、生産、発送を挙げています。必要なKDEは、実行されているCTEによって異なります。 各CTEで必要とされる記録には、食品のトレーサビリティ・ロットコードが含まれ、関連するKDEにリンクされている必要があります。
2.トレーサビリティプログラムの記録
上記に加えて、提案された規則では、FTL上で食品を製造、加工、梱包、または保管する者に対して、トレーサビリティプログラムの記録を確立し、維持することを要求しています。これらの記録は、規制当局が企業のトレーサビリティプログラムを理解するのに役立つことを目的としており、以下の内容が含まれます。
- 関連する参照記録の説明
- 出荷されるFTL上の食品のリスト
- トレーサビリティ・ロットコードの割り当て方法の説明
- 必要な記録内で提供されるデータを理解するために必要なその他の情報
免除及び修正要件
提案された規則には、以下のような免除項目があり2020年10月の弊社FDA関連ニュースでご案内させて頂きましたキルステップ(食品中の病原菌を大幅に最小化するプロセス)適用を含め、以下のような免除対象があります。
- 特定のタイプの小規模な農家など作物の生育者に対する免除
- 消費者に直接販売する農場の免除
- 特定の加工を受ける食品の免除
- 生で消費されることが稀な農産物の免除
- 特定の混合される生の農産物の免除
- 小規模小売食品事業者向け
- 食品小売業の一部免除
- 農園から直接学校や特定の施設へ販売されるプログラムの一部免除
- 漁船内でのプロセスへの一部免除
- 運送業者への適用免除
- 非営利食品施設の免除
- 個人消費目的食料の免除
- 個人消費者目的の食品を保管する者の免除(ホテル受付やアパートの管理人など)
- キルステップの対象となる食品の特別要件
FTLの食品にキルステップ(つまり、調理や低温殺菌など病原体を大幅に最小限に抑える処理)を適用する場合、キルステップの適用を文書化した記録を維持していれば、その後の食品の出荷に対してこの規則で要求される記録を維持する必要はありません。キルステップが適用されたFTLの食品の後続の受信者は、このルールで要求される記録を維持する必要はないとするものです。
施行日
FDAは、FTL上の食品の追加のトレーサビリティ記録保持要件に関する最終規則について、連邦官報に公開されてから60日後に発効することを提案しています。
効果的なトレーサビリティシステムは、サプライチェーン内のすべての事業体がトレーサビリティ記録を維持することを必要とするため、FDAは、規則の対象となるすべての者が同じ日までに遵守するべきであると考えており、記録保持要件の対象となるすべての者の遵守日を最終規則の発効日から 2 年後とすることを提案しています。
詳細は、FSMA Proposed Rule for Food Traceabilityをご参照ください。
2020年11月10日
FDA、食品ラベルの原材料リストでゴマの使用を明確にすることを食品メーカーに奨励
 米国食品医薬品局(FDA)は、食品メーカーに対し、食品ラベルの原材料リストにゴマを自主的に表示するよう促すガイダンス案を発表しました。
米国食品医薬品局(FDA)は、食品メーカーに対し、食品ラベルの原材料リストにゴマを自主的に表示するよう促すガイダンス案を発表しました。
FDAの食品安全・応用栄養センターの所長であるSusan Mayne博士は、「多くのアメリカ人はゴマにアレルギーがある、または敏感であり、ゴマを含む可能性のある製品を特定することが必要です。ゴマを含むほとんどの製品は、ゴマを原材料として表示していますが「フレーバー」や「スパイス」として使用する場合など、ゴマを表示しなくても良い場合もあります。他にも「タヒニ」のようにゴマをすり潰してペースト状にしたものもありますが、タヒニがゴマから作られていることを知らない消費者もいます。このような場合、ゴマは製品のラベルの原材料リストに名前で表示されていない場合があります。私たちは、食品メーカーに対し、ゴマを使用した製品を作る場合には必ず自主的に原材料としてゴマを記載することを奨励します。」と述べています。
2018年10月30日、FDAは、米国でのゴマアレルギーの発生と重症度、および成分としてゴマを開示する必要のない米国でのゴマ含有食品の普及に関するデータと情報を求める通知を発行しました。米国におけるゴマアレルギーの正確な頻度は不明ですが、最近の調査では0.1%を超えると推定されており、これは大豆や魚のアレルギーと同レベルです。FDAに寄せられた回答では、ゴマを使用した事が表示されていない製品やタヒニのような原材料を含む製品を消費し、じんましん、嘔吐、喘鳴、アナフィラキシーなどのアレルギー反応が発生している可能性があることが示されています。 連邦法では、8つの「主要な食物アレルゲン」(牛乳、卵、魚、甲殻類、木の実、ピーナッツ、小麦、大豆)を含む食品は、ラベルに一般名または通常の名前を使用してアレルゲンの食物源を明確にすることが義務付けられています。食品アレルゲン表示および消費者保護法(FALCPA)は、これらの8つの主要なアレルゲンを含む食品には、アレルゲンの存在を明確に示すという厳格な要件を課しており、FDAは食品メーカーと緊密に連携し、表示されていない場合には速やかに市場からそのような製品をリコールするようにしています。ゴマは現在8つの主要アレルゲンの1つではありませんが、FDAはこのガイダンス案を通じて、食品メーカーが製品にゴマが含まれている場合には、自主的にラベルを明記することを奨励しています。
さらに、FDAは、これらのアレルゲンに関する情報を消費者に提供するための科学的根拠に基づくオプションを含め、公衆衛生上重要なアレルゲンの評価を継続的に行っています。
詳細は以下のガイダンスをご参照ください。
FDA Encourages Manufacturers to Clearly Declare All Uses of Sesame in Ingredient List on Food Labels | FDA
2020年10月30日
FDAと国土安全保障省、国際郵便施設での違法・有害な医薬品の輸入防止追加措置を講じる
 FDA、米国税関国境警備局(CBP)、米国移民関税執行局国土安全保障調査局(ICE-HSI)は、国際郵便施設(IMF)を通じて米国に輸入され公衆衛生に脅威を与える有害な製品を阻止するための覚書(MOU)に署名しました。MOUは、この違法行為を防止するために、検査および検出機能を強化します。
FDA、米国税関国境警備局(CBP)、米国移民関税執行局国土安全保障調査局(ICE-HSI)は、国際郵便施設(IMF)を通じて米国に輸入され公衆衛生に脅威を与える有害な製品を阻止するための覚書(MOU)に署名しました。MOUは、この違法行為を防止するために、検査および検出機能を強化します。
この共同作業の中核として、CBPとICE-HSIは引き続きFDAと協力してIMFでの共同作業を行い、フェンタニルやその他の未承認または違法薬物、違法医療機器、違法栄養補助食品や違法オピオイドに注目していきます。このパートナーシップは、公衆衛生にリスクをもたらす可能性のある詐欺、偽造、または違法なCOVID-19関連製品を阻止するための継続的な努力においても重要です。さらに、両機関は、協力的な情報共有、施設の共有、および将来の調整されたオペレーションを通じて、進行中の活動を調整するために尽力します。
「アメリカ人が受け取った製品が信頼できる、米国の法律に準拠している製品である事を確実にする必要があります。私たちが発表した協力的な取り組みにより、違法で有害である可能性のある製品が米国に流入するのを防ぐための、より多くのリソースを活用した効果的、効率的な監視が可能になり、それによって、米国国民の健康と安全を守るという重要な使命を達成することができます。連邦政府パートナーとの強力な関係を活用して、偽造および未承認の医療製品の米国への違法な流入を阻止することに引き続き取り組んでいます。」と、FDA長官のStephen M. Hahn医学博士は述べています。 「国際郵便と速達貨物は、麻薬密輸業者の主要な経路となっています。 一方、取引量が急増し、電子商取引と迅速な輸送ロジスティクスによって、法執行がより困難になっています」とCBP長官代理のMark A. Morgan氏は述べています。 「FDAとICEのこのパートナーシップは、これらの危険な薬物が私たちのコミュニティに到達するのを阻止するために追加のリソースとツールを提供する政府全体のアプローチを確実にします。」
「FDAとCBPは、危害をもたらす可能性のある偽造品から米国民を保護するという我々の使命において、重要なパートナーです」と、ICEのTony H. Pham局長の職務を遂行する高官は述べています。「ICE HSIの特別捜査官は、連邦商標、著作権、特許法の違反を調査して執行し、偽造行為を取り締まり、それらに関与する個人に責任を負わせるために取り組んでおり、それによって合法的なビジネスへのリスクを軽減し、公共の安全を確保します。」
FDAとCBPは2019年4月に、IMFでの検査と検出能力を最大限に発揮するための基本合意書に署名しました。この合意書によると、FDA、CBP、およびICE-HSIは、入ってくる違反小包の傾向を迅速かつ効果的に特定するために、情報の種類と共有の方法を拡張させます。この協力関係では、一般的なデータポイントと特定のデータポイントの両方の共有が含まれ、これらのデータポイントは、問題の有り得る製品の輸入をターゲットにし将来の施行戦略を知らせるために使用することができます。この取り組みのもう一つの焦点は、取扱量の多いIMFのロケーションにてリアルタイムでのエントリーの決定とデータ共有の増加を促進しサポートすることです。 FDAが9つのIMFすべての施設で行政権限を実施した2016年4月以降、FDAは重量41.2トンを超える1,290万個以上のカプセル/錠剤などを破棄しました。FDAにより破棄された約1,300万個の違反薬物は31,000人以上の米国の消費者に向けられていたもので、これを阻止した事でFDAの公衆衛生を守るという使命にかなっています。 オピオイド患者と地域を支援するSUPPORT法(SUPPORT:Substance Use-Disorder Prevention that Promotes Opioid Recovery and Treatment for Patients and Communities Act)の下、議会から提供された新たな権限とリソースにより、FDAは特定の有効な医薬品成分(API)を含む違反薬物のより効率的な破棄プロセスを構築し、全国のIMF拠点での活動を拡大することが可能となり、より迅速な現場での科学的なサポート、スタッフの増員、作業施設の改善を実現する事が可能になりました。
2019会計年度(FY)に、FDAはIMF施設で41,000製品以上の製品を含む約25,200個の小包をスクリーニングしました。FDAはこれらの製品のうち35,000製品を超える製品の入国を拒否し、半数近くを違反薬物として認定し、FDAの行政権限の下、破棄しました。2020会計年度はこれまでのところ、FDAは約43,000のFDA規制製品を含む約27,500個の小包をスクリーニングしました。これらの製品のうち、34,000を超える製品の入国を拒否し、破棄された違反薬物製品は24,000を超えています。
2020年9月27日
FDA向け食品施設登録は2020年10月1日から12月31日の間に更新- DUNS番号の提出要
米国食品医薬品局(FDA)は、2020年10月1日から始まったFDAへの施設登録登録またはFDA施設登録登録の更新の際に、施設識別番号(UFI*=Unique Facility Identifier)の提出を求めています(21 CFR 1.232 (a)(2))。
米国内で消費される食品を製造、加工、包装、または保管するすべての施設に対し、2020年10月1日から12月31日までの間に施設登録を更新するよう求めていますが、これには、今年登録した施設も含まれます。例えば、たとえ施設が2020年9月30日に登録されたばかりでも、登録を更新する必要があります。
FDAは偶数年に施設登録の更新を義務付けていますが、今年からの変更点は、米国内、米国外の施設ともに、更新の際に施設識別番号(UFI)の提出が必要になったことです。まだUFIをお持ちでない施設は、直ちにUFIを申請することをお勧めします。この新しい要件を満たすために多くの施設がUFIを申請することで、UFI申請が滞る可能性があり、UFIの発行が遅れると、施設の更新が間に合わなくなるリスクがあります。更新期間中に施設登録の更新を行わなかった場合には、登録が取り消される可能性があるので要注意です。
ご参考:
UFIの提出は、2016年にFDAが発表した以下の規則において定められておりますのでご参照ください。
https://www.fda.gov/food/cfsan-constituent-updates/fda-issues-final-rule-under-fsma-update-food-facility-registration
*FDAが認識しているUFIとはDUNS番号のことですので、DUNS番号を入力の上で登録し直す必要があります。DUNS番号については以下のウェブサイトからログインしてください。FDA目的のDUNS番号取得は費用がかかりません。
https://www.fdadunslookup.com/
また、DUNS番号に関する対応方法は以下のリンクをご参照ください。
https://www.fda.gov/media/95828/download
2020年9月21日
食品安全強化法(FSMA)に基づく食品トレーサビリティ規則案を発表
 米国食品医薬品局(FDA)は、特定の食品についてトレーサビリティ記録の追加要件を定める規則案を発表しました。FDAはまた、提案された要件の対象となる食品を記載した「食品トレーサビリティリスト」案を公表しました。リストには、葉菜類、新鮮なカットフルーツや野菜、魚、殻付き卵、ナッツバターなどが含まれています。
米国食品医薬品局(FDA)は、特定の食品についてトレーサビリティ記録の追加要件を定める規則案を発表しました。FDAはまた、提案された要件の対象となる食品を記載した「食品トレーサビリティリスト」案を公表しました。リストには、葉菜類、新鮮なカットフルーツや野菜、魚、殻付き卵、ナッツバターなどが含まれています。
提案された規則「特定の食品のトレーサビリティ記録に関する追加的な要件」(食品トレーサビリティ提案規則)は、FDAの新時代のスマートな食品安全の青写真の重要な構成要素であり、FDA食品安全強化法(FSMA)のセクション204(d)を実施することになります。本提案が最終化されれば、企業が確立・維持すべきデータ要素と情報が標準化され、そして、迅速かつ正確なトレーサビリティを促進するためにサプライチェーンの次の事業者に送信するべき情報が標準化されることになります。特定の食品に限定されますが、この提案は、トレーサビリティの記録保持に対する標準化されたアプローチの基礎を築くもので、業界が将来、より多くのデジタルトレーサビリティシステムを採用し、調和させ、活用するための道を開くことになります。FDAは、導入にあたり可能な限り、業界各社が既に使用している既存のコンセンサス標準を参考にする方向で動いています。
既存の FDA 規制下、食品業界の多くが直前のサプライヤーと直後の食品の販売先を特定するための記録を確立および維持する必要があります(一般的に「ワンアップ・ワンバック」記録管理と呼ばれます)。これらの要件は、トレーサビリティ記録管理のベースラインを形成していますが、サプライチェーン全体の各ポイントを通じて食品の出荷を効果的かつ迅速につなげるための情報としては限度があります。さらに、記録管理システムの大部分が紙ベースであることや、業界全体で共通の用語が存在しないことから、必要な時に製品を元の出所まで辿ることが難しい場合があります。
その結果、食中毒発生などの事故があった場合の発生調査が遅れ、病気の増加と経済的損失をもたらしています。今回提案された規則で想定されるようにトレーサビリティが改善されれば、FDAは汚染された製品の出所をより迅速に特定し、製品のリコールの範囲を縮小し、汚染がどのようにして発生したのかを知るための根本的な原因調査をよりタイムリーに行うことができるようになると期待されています。その結果、食中毒の防止に繋がることも可能になると考えられます。
この提案の重要な点は、食品トレーサビリティリスト(FTL)に掲げられている食品を製造、加工、梱包、保管する会社は、特定のクリティカルトラッキングイベント(CTE)(作物生育、受入れ、加工、生産、発送)に関連した記録を確立し、維持することを要求することです。各 CTE について、事業者は主要データ要素(KDE)を含む記録を確立し、保持する必要があります。KDE の例としては、トレーサビリティ・ロットコード、製品の受領日、製品の出荷日、製品の説明が含まれます。トレーサビリティ・ロットコードは、食品由来の病気の発生やリコールの際に、迅速なトレースバック及びトレースフォワード調査を容易にするための重要なつながりを確立するサプライチェーン全体における重要なKDEです。さらに、規則の対象となる企業は、内部トレーサビリティプログラムに関連した記録を作成し維持することが必要となるため、当局が企業の記録管理の実践とトレーサビリティの運用をよりよく理解するのにも役立ちます。
提案された規則では、記録は電子的、紙のオリジナルの記録、またはコピーのいずれかの形で保持することが必要とされています。さらに、本提案では、食品由来の病気の発生、製品のリコール、または公衆衛生に対するその他の脅威が発生した場合には、FDAは24時間以内に、特定の食品および日付範囲の関連するトレーサビリティ情報を含む電子ソート可能なスプレッドシートを24時間以内に提出するよう企業に対して要求することができるとしています。FDAは、すべての食品事業者が可能な限りトレーサビリティ記録を電子的に維持し、公衆衛生への脅威に対処する必要がある場合にトレーサビリティ情報の特定を促進することを推奨しています。
提案されている規則の要件は、FTLに載っている食品にのみに適用されますが、これには食品を原材料として使用する場合も適用されます。なお、提案された規則には免除対象が含まれており、例えば、キルステップ(食品中の病原菌を大幅に最小化するプロセス)が食品に適用された後は、追加のトレーサビリティ記録は必要ないとされています。これに関しては、キルステップ適用に係る書類が確立され、維持されていなければなりません。
提案された規則案と食品トレーサビリティリストの素案は、公表日から120日間パブリックコメントにかけられます。また、FDAはパブリックコメント期間中に3回のパブリックミーティングを開催します。パブリックミーティングに関する情報は、近日中に発表される予定です。
ご参考:
追記:
2020年10月5日の連邦官報で、FDAは、提案された新しいトレーサビリティ規則に関するパブリックミーティングの詳細を公開しました。 これらのミーティングはパンデミック下、オンラインで開催されます。 この3つの公開会議はすべて、同じ議題項目をカバーしていますが 異なるタイムゾーンの人に対応するために、次のように異なる時間帯で行われます。
- 2020年11月6日午前8時30分から午後3時30分(米国東海岸時間)
- 2020年11月18日午前9時30分から午後4時30分(米国東海岸時間)
- 2020年12月2日午前11時30分から午後6時30分(米国東海岸時間)
2020年8月31日
輸入審査に係る試験的プログラムとして人工知能を活用
FDA長官Stephan M. Hahn (M.D.) によるコメント
 FDAは科学に基づいた規制機関としてデータの重要性とデータ収集・レビュー・分析の高度なメカニズムを駆使してデータの力を解き放ち、予防的で行動指向型のデータ有効利用の重要性を強調してきています。
FDAは科学に基づいた規制機関としてデータの重要性とデータ収集・レビュー・分析の高度なメカニズムを駆使してデータの力を解き放ち、予防的で行動指向型のデータ有効利用の重要性を強調してきています。
この取り組みの一例として、FDAのイニシアティブ「よりスマートな食品安全の新時代」の一環として、人工知能(AI)を活用するためにFDAが取り組んでいるプログラムについてご紹介します。このプログラムにより、FDAは公衆衛生安全の使命を強化するために利用可能なデータソースを適用するための重要かつ新しい方法を見つけることができると期待しています。最終的な目標は、AIが公衆衛生に脅威を与える可能性のある製品を迅速かつ効率的に識別する能力を向上させることができるかどうかを見極めることです。
FDAがAIの活用を評価している分野の一つに、輸入食品のスクリーニングがあります。米国人は、様々な食品を楽しみたいと思っており、国産、輸入品両方に対し安全な食品であることを望んでいます。
そこでFDAは2019年春に、AI、具体的には機械学習(ML)をFDAの輸入審査プロセスで使用することにより得られる付加価値を学ぶための試験的プログラムを開始しました。ML学習はAIの一種で、人間や現在の規制に基づいたスクリーニングシステムではわからないようなデータのつながりやパターンを自動的に特定し、データを迅速に分析することを可能にします。
この試験的プログラムの第一段階は、FDAが取っているアプローチを検証するための「概念実証」でした。私たちは、AI/MLを使用して、安全でない可能性のある魚介類をより一層ターゲットにする事の有効性を評価するために、輸入された魚介類でこのアプローチをテストすることにしました。
なぜシーフードなのかというと、米国はシーフード消費量の94%をも輸入に依存しているからです。
予測能力の強化、概念実証
FDAは、過去の水産物の中で拒否されたものや、現場での調査、ラベル検査、サンプルのラボ分析などの追加検査を受けたものから得られた数年間のデータを用いて、MLスクリーニングツールをトレーニングすることにより、コンセプトの実証に着手しました。これにより、これらの技術を使用して監視活動をどの程度改善できるかを知ることができました。
結果はとても素晴らしく、このアプローチは、より低リスクの魚介類貨物の許可を迅速化し、より高リスクのものを識別するツールとして有効活用できる可能性がある事を示唆するものでした。概念実証では、AI/MLにより、公衆衛生上の懸念がある製品を含む貨物を特定できる可能性がほぼ3倍になることが実証されました。
この試験プログラムの実行チームは現在、この作業の第二段階の一部として、AI/MLモデルのアルゴリズムを現場条件に適用する作業を行っています。インフィールドの試験的取組みの一環として、このモデルは、FDAのスタッフがどの貨物を検査するかを決定するために使用されるスクリーニング方法に適用され、その後、貨物の中のどの食品をラボ試験用にサンプルするかについての情報を提供します。そして、その結果を現在のシステムが行っている推奨事項と比較します。
FDAはこの試験プログラムを、FDAが直面している製品やプロセスの課題にAIの力を活用するための重要なステップと捉えています。私たちの初期の概念実証の結果は、このような革新的なアプローチが、消費者の保護をさらに強化する上で大きな可能性を秘めていることを示しています。
公共衛生の安全を守るためにデータの持つ力を解き放つ
この試験的プログラムは、FDAの2つの重要な新しいイニシアティブを利用しています。よりスマートな食品安全の新時代に加えて、それはまた、私たちの技術近代化アクションプラン(TMAP)で具体化された優先事項を反映しています。
7月13日、FDAは、よりデジタルでトレーサビリティが高く、より安全な食品システムを作成するために、新しい技術やアプローチを活用する方法を概説する、スマートな食品安全の新時代の青写真を発表しました。
この青写真を作成したとき、FDAは、AI技術がFDAの予測分析能力を拡大し、データを掘り起こして食品由来のリスクを予測して軽減できるようにするためのゲームチェンジャーになることを認識していました。この試験的取組みによって、この技術には輸入食品の安全性確保に役立つ具体的で即効性のあるメリットがある事が明らかになってきています。
TMAPには、コンピュータのハードウェア、ソフトウェア、データ、分析、先進技術ツールなどの技術情報システムを近代化するための重要なアクションが記載されており、FDAが公衆衛生の使命を追求することを加速化させることができます。
さらに、この計画では、製品やプロセス技術の急速な進歩が米国の消費者や患者にとって意味のある結果をもたらすよう、必要な技術ソリューションとのギャップを埋めるために、FDAがどのようにコンピューティングと技術インフラを変革していくかを説明しています。TMAPは、データそのものをめぐるFDAの戦略(データの管理、セキュリティ、品質管理、分析、リアルタイム利用のための戦略)を発展させるための基盤を提供しています。
これらのイニシアティブはいずれもCOVID-19パンデミックの前から進行していましたが、この危機的時期に得られた教訓は、公衆衛生を保護するためのよりリアルタイムでデータ駆動型のアプローチの重要性です。
膨大な量のデータのスケーリング
この試験的取組みはまた、毎年何百万もの輸入貨物をスクリーニングして得た膨大なデータから必要な知識を紐解く方法を学ぶ機会を与えてくれています。2019年、FDAは、米国消費者に販売する目的で米国に輸入された約1,500万の食品貨物をスクリーニングしました。昨年、米国は消費する食品の約15%を輸入しており、その割合は増加し続けています。
FDAは、これらの輸入貨物と、その食品を生産・加工し、輸入し、米国市場で販売している企業に関する膨大な量のデータを持っています。実際、FDAは毎年、輸入品だけでも数千万件のデータポイントを収集しており、食品の貨物に関連するすべてのデータを内部データベースの情報と照らし合わせてスクリーニングしています。今回の試験的取組みの主な目的の一つは、AI/MLがシステム内にあるすべてのデータや情報をより迅速に、効率的に、そして包括的に活用できるかどうかを評価することです。
実際、MLが提供する知識は、安全でない可能性のある製品を見つけるには、どこにリソースを集中させるべきなのかを知るために利用することができると考えられます。輸入監視リソースの改善に加えて、FDAの収集データからMLが抽出できる情報は、どの施設を検査するか、どのような食品が人々に病気をもたらす可能性が高いか、またその他のリスクの優先順位を決める際の判断材料にもなります。
時代や技術の変化に伴いFDAは変化してきていますが、目標は不変で、公衆衛生を保護する方法を強化するためにできる限りのことを行うことです。
----------
COVID-19によるパンデミック下、マスク、ガウン、ハンドサニタイザー等のPPE(個人保護用具)に関して、FDAは供給不足を緩和する目的で一時的に一部の規制の緩和を発表しています。しかし、製造会社や輸入業者は一時的規制の一部の緩和を利用して米国で販売を開始するにあたり、FDAによって何がどのように緩和されて、リスクを最小限に抑えるためにFDAはどのようにこの緩和によるリスクの管理しているのかをよく理解している必要があります。本件についてのアドバイスをご希望の方は以下までお問い合わせください。info@eureka-global.net
ボイド敏子 / 小野恵梨子
2020年6月19日
FDAは消費者に対し、Eskbiochem社のハンドサニタイザーを使用しないよう注意喚起
 米国食品医薬品局(FDA)は、メキシコのEskbiochem社製のハンドサニタイザーに関して、人体に有毒なメタノールが含まれている可能性があることから、消費者に使用しないよう注意喚起しています。FDAは、Eskbiochem社の以下の製品を対象製品として特定しています。
米国食品医薬品局(FDA)は、メキシコのEskbiochem社製のハンドサニタイザーに関して、人体に有毒なメタノールが含まれている可能性があることから、消費者に使用しないよう注意喚起しています。FDAは、Eskbiochem社の以下の製品を対象製品として特定しています。
- All-Clean Hand Sanitizer (NDC: 74589-002-01)
- Esk Biochem Hand Sanitizer (NDC: 74589-007-01)
- CleanCare NoGerm Advanced Hand Sanitizer 75% Alcohol (NDC: 74589-008-04)
- Lavar 70 Gel Hand Sanitizer (NDC: 74589-006-01)
- The Good Gel Antibacterial Gel Hand Sanitizer (NDC: 74589-010-10)
- CleanCare NoGerm Advanced Hand Sanitizer 80% Alcohol (NDC: 74589-005-03)
- CleanCare NoGerm Advanced Hand Sanitizer 75% Alcohol (NDC: 74589-009-01)
- CleanCare NoGerm Advanced Hand Sanitizer 80% Alcohol (NDC: 74589-003-01)
- Saniderm Advanced Hand Sanitizer (NDC: 74589-001-01)
FDAがLavar GelとCleanCare No Germのサンプルをテストした結果、Lavar Gelは81%(v/v)のメタノールを含み、エチルアルコールは含んでおらず、またCleanCare No Germは28%(v/v)のメタノールを含んでいました。メタノールは毒性があり、ハンドサニタイザーに使用する事ができない成分です。
メタノールを含むハンドサニタイザーを使用した消費者は、メタノールの毒性による悪影響の可能性があるので、救急治療を受ける必要があります。ヒトはメタノールへの大量な暴露があると、吐き気、嘔吐、頭痛、視力障害、永久失明、痙攣、昏睡、神経系への永久的な損傷、さらには死に至る可能性もあるとされています。これらの製品をハンドサニタイザーとして手指に使用しているヒトが危険にさらされているのはもちろんの事、これらの製品を誤って摂取した幼児やアルコール(エタノール)の代用品として飲んでしまったヒトが、メタノール中毒のリスクが最も高いとされています。
2020年6月17日、FDAはEskbiochem社に連絡し、メタノール中毒に伴うリスクを理由に同社のハンドサニタイザー製品を市場から即排除するよう勧告しました。現在までのところ、同社はこれらの潜在的に危険な製品を市場から排除するための措置を取っておらず、FDAは消費者にこれらのハンドサニタイザーの使用を中止し、直ちに適切な有害廃棄物用の容器に廃棄することを推奨しています。これらの製品を流したり、下水に流したりしないでください。
COVID-19パンデミック下、FDAは消費者に対して、少なくとも20秒間石鹸と水で頻繁に手を洗うように消費者に忠告しています。トイレ使用後、食事前に、そして咳やくしゃみ、鼻をかんだ後は特にそうすべきとしています。石鹸と水が利用できない場合は、アメリカ疾病管理予防センター (CDC) は消費者に対して、少なくとも60 % のエタノールを含有するアルコールベースのハンドサニタイザーを使用することを推奨しています。
FDAは今後もハンドサニタイザーの品質をモニターし、不適切な製品が販売されている場合には対処していきます。さらにFDAは、COVID-19を含むウイルスに対して長時間(24時間)保護する効果があると謳った、ハンドサニタイザーに関する虚偽や誤解を招くような訴求内容についても、裏付ける証拠がないことから懸念しています。
現在までのところ、FDAはこれらのハンドサニタイザー製品に関連した有害事象の報告を把握していませんが、医療従事者、消費者、患者に対して、FDAのMedWatch Adverse Event Programにハンドサニタイザーの使用で経験した有害事象や品質問題を報告することを奨励しています。
2020年5月22日
FDAは、COVID-19パンデミック下、ヒト用食品の特定の表示要件に関して、一時的に柔軟性のある方針を発表
 米国食品医薬品局(FDA)は、製造業者や自動販売機運営会社に対して、食品表示ラベル要件に一時的な柔軟性を与えるガイダンス文書を発行しました。適切な場合には規制を柔軟にし、現在のパンデミックに伴うサプライチェーンの混乱が製品の可用性に与える影響を最小限に抑える事を目的としています。
米国食品医薬品局(FDA)は、製造業者や自動販売機運営会社に対して、食品表示ラベル要件に一時的な柔軟性を与えるガイダンス文書を発行しました。適切な場合には規制を柔軟にし、現在のパンデミックに伴うサプライチェーンの混乱が製品の可用性に与える影響を最小限に抑える事を目的としています。
「COVID-19公衆衛生上の緊急事態における特定の食品表示ラベル要件に関する暫定的な方針:軽微な成分変更及び自動販売機」と題されたこのガイダンスは、FDAが発行したガイダンスのうちの1つであり、パンデミック時に食品のサプライチェーンをサポートして消費者の需要を満たすため、食品業界に一時的な柔軟性を与えるものです。
このガイダンスによると、第一に、FDAは、成分に軽微な変更があった場合、ラベルの成分リストを変更する事を義務付けておらず、製造業者が軽微な成分変更を行えるよう柔軟性を与えています。本ガイダンスの目的に沿う、軽微な成分変更は、以下に記載されている一般的な要素と一致している必要があります。
- 安全性:ラベル表示されている成分の代わりに使用される成分が、健康に悪影響を及ぼすことがないこと(食物アレルゲン、グルテン、亜硫酸塩(酸化防止剤)、人によっては過敏症を引き起こすことが知られている食品、例えばグルタミン酸などを含む)。
- 量:一般的には、含有量が完成した食品の重量の2%以下であること。
- 主要成分:含まれなかったり、代わりの成分が使われている場合は、製品にとっての主要な成分ではないこと。
- 特徴付け成分:含まれなかったり、代わりの成分が使用されている場合は、製品を特徴付ける成分ではないこと。例えば、レーズンパンの特徴であるレーズンを省くのは問題。
- クレーム:成分が含まれなかったり、または代替が、ラベル上の任意の栄養成分含有量または健康に関するクレームには影響しないこと。
- 栄養/機能性:成分が含まれなかったり、代替が、栄養の違いや機能性を含め、最終製品に大きな影響を与えないこと。
具体例はガイダンスに記載されているように、例えば、ラベルの成分リストを変更することなく、少量の複数の野菜を含むベジタブルキッシュの成分を一時的に減らしたり、省略したりすることができます(例:ピーマン)。 キャノーラ油をヒマワリ油に代用するといった、特定の油の代用は、これらが類似した種類の脂肪を含むため、ラベルの変更なしに一時的に柔軟な対応が可能です。
成分変更について一時的に柔軟性を与えている例として、他に「漂白小麦粉」があります。FDAは現在、小麦粉漂白のための成分のサプライチェーンに大きな混乱が生じている事を把握しているため、漂白小麦粉の不足が続く間、ラベルを変更することなく、未漂白小麦粉を漂白小麦粉に置き換えることができるよう、一時的に柔軟性を与えています。
ガイダンスでは、食品表示ラベル規制における既存の柔軟性の例も示しています。一例として、ラベルが一般的な用語 「スパイス」と表記している場合に他のスパイスに代替できるという柔軟性があります。
第二に、FDAは自動販売機業界にも一時的な柔軟性を与えていて、現時点において自動販売機で販売されている食品のカロリー情報を提供するためのラベル表示要件を満たしていない場合でも、現在の一時的措置により問題にはなりません。パンデミックの結果として、自動販売機の運営会社は自動販売機で販売される食品のサプライチェーンに一時的な混乱が生じているかもしれません。可能である限り、FDAは、自動販売機の運営会社に対して、自動販売機のラベル表示要件を継続して遵守していく事を奨励はしています。
FDAは発行した一時的な柔軟性措置として、食品包装の栄養表示、メニュー表示、殻付き卵の包装とラベル表示、及び、小売店への卵の流通についての方針について触れています。
2020年4月3日
FDAはCOVID-19パンデミック下、一時的に食品輸入者にFSVPの遠隔査察を実施
米国食品医薬品局(FDA)は、COVID-19による公衆衛生上の緊急事態の間、外国供給者検証プログラム(FSVP)ルールへの遵守を確認するため、輸入業者に対して遠隔で検査することを発表しました。
「FSVPの規制の下でFDAは、輸入業者が電子的にまたは他の迅速な手段によってFDAに記録を提供するよう、書面による要求を行う権限を持っている 」、「COVID-19の発生に関連する出張制限、ソーシャルディスタンスの維持、及びその他勧告のため、FDAは、この時点ではほとんどの現場(オンサイト)検査を実施することが一時的に非現実的であると決定しました。」とFDAは述べました。
FDAは、これらの遠隔FSVP検査を直ちに開始する意向で、COVID-19により検査が延期された輸入業者を優先する予定です。2019年度の食品業界の検査結果で、違反で最も多かったのは、FSVPを作成していないことでした。その他のFSVP関連の違反としては、以下のようなものが多くありました。
- FSVPに従っていない、または維持していない
- 該当箇所で、FSVPを英語に翻訳できていない
- 変更時にFSVPへの署名や日付記入がされていない
- 供給業者の食品安全性の適切な保証ができていない
※FSVP(外国供給業者検証プログラム)について
FSVP規則により、米国の食品・飲料輸入業者は、食品安全システムを策定する能力を反映した適切な訓練を受けているか、または職務経験を有しているとFDAが定義した「適格者」を指定し、外国の供給業者からの食品ごとにFSVPを策定することを要求しています。これは、単一の供給者からの複数の食品、又は、複数の供給者からの単一の食品の複数のユニットが、それぞれ個別の FSVP を必要とすることを意味します。FSVP には、危害分析、リスク及び供給業者のパフォーマンスの評価,文書化された供給業者の検証活動、及び、供給業者が不適合を発見した場合の是正措置のための計画を含むいくつかの要素が必要です。
FSVP では、予防措置が講じられていない場合に病気等を引き起こす可能性のある生物学的、 化学的、物理的の潜在的危害を特定し、危害分析を実施しなければなりません。輸入者は、製造手順、原材料及び成分、食品の輸送、保管、流通などの多様な変数を考慮しながら、これらの対策が実施されなかった場合の病気等の発生する確率と重症度を評価しなければなりません。
リスクと供給業者のパフォーマンスの評価は、供給業者から輸入する際のリスクのレベルを判断するために、 供給業者の食品安全性の実践と手順、米国食品安全規制の遵守状況、食品安全性問題の是正歴を評価しながら、危害分析の結果を考慮すべきです。輸入業者は、供給業者がもたらす食品安全リスクのレベルに関連して、適切な検証手段を決定する必要があり、検証活動には、現場監査、サンプリング、及び/又は、供給業者の食品安全記録のレビューが含まれます。
食品安全上の問題が発生した場合、輸入業者は、供給業者との問題を是正するための適切な措置をとることがFDAによって義務付けられています。是正措置は、特定の問題に応じて異なりますが、深刻な場合には、供給業者の適合性が確認されるまで、輸入業者が供給業者との取引を停止しなければならない場合もあります。そのような問題の一つとして、供給業者がFSMA予防管理規則で要求されている食品安全計画を保持していない事が挙げられます。
FSVP検査は、従来のFDAが実際に食品施設に訪れて実施する検査とは異なります。FSVP検査は,輸入業者が供給業者と食品品目について,FSVP規則で要求される詳細な要素を全て適切に有しているかどうかを検査するものです。FSVP検査官は、輸入業者と供給業者の間で FSVP で定められている手続が実施されている証拠をレビューしたり、輸入業者が適切な危害分析や検証活動を文書化し、適格者がレビューしているという証拠を確認する事も行います。
ただし、食中毒の発生に対応するためなどの深刻な状況については、FDAは現場でFSVP検査を実施することを選択することがあります。このような場合、FDAの検査官は、米国疾病予防管理センターが推奨するソーシャルディスタンスの確保を実践しながら、検査実施に向けた手配を行います。
検査手順の一時的な変更についてご質問のある方は、以下までお問い合わせください。
FDAImportsInquiry@fda.hhs.gov
2020年3月9日
FDA、タルク含有化粧品のアスベスト検査の最終報告書を公表
 以下の引用は、米国食品医薬品局(FDA)の食品安全・応用栄養センター長であるSusan Mayne博士によるものです。
以下の引用は、米国食品医薬品局(FDA)の食品安全・応用栄養センター長であるSusan Mayne博士によるものです。
「FDAは、汚染された化粧品から消費者の安全を守るために尽力しています。この取り組みの一環として、FDAは2018年9月、AMA Analytical Services, Inc. (AMA)に、タルク含有化粧品にアスベストが含まれているかどうかを検査する1年間の契約を発注しました。私たちは化粧品が安全ではないと判断した場合には迅速な対応をとっており、今後も継続して参ります。」
「米国の連邦機関と世界保健機関の間では、アスベスト曝露には既知の安全レベルは存在しないという一般的な同意があります。今月初めの公開会議で、FDAは連邦政府のパートナー、業界の専門家、及び一般市民からの意見を集め、タルク含有製品やタルクを成分として使用する製品の汚染物質として存在する可能性のあるアスベストやその他の有害な細長い鉱物粒子を識別し、測定するため標準化された試験方法基準等の開発を実施しました。この分野での作業は現在進行中であり、最新情報が入り次第、引き続き一般の方々にもお伝えしていきます。」
- FDAは本日、タルクを含む化粧品にアスベストが含まれているかどうかを検査するために、1年間に亘って行ってきたサンプリング作業から、6つのパートに分けてAMA Analytical Services, Inc.の最終報告書を発行しました。
- 結果は、43サンプルがアスベスト陰性で、9サンプルがアスベスト陽性でした。
- FDAは直ちに陽性結果について一般に通知し、この結果に関連している企業とリコールについて緊密に連携しました。最終報告書では、AMAが2019年に試験したタルク含有化粧品の陽性結果と陰性結果の両方をリストアップしています。
- FDAは、AMAによるブラインドテストのために選択された50個のサンプルを追加した上で、2020年を通じて別のタルクのサンプリング作業を実施し、陽性の結果が出た場合にはその旨を連絡するつもりです。最終結果は2021年の初頭に発表される予定です。
COVID-19によるパンデミック下、マスク、ガウン、ハンドサニタイザー等のPPE(個人保護用具)に関して、FDAは供給不足を緩和する目的で一時的に一部の規制の緩和を発表しています。しかし、製造会社や輸入業者は一時的規制の一部の緩和を利用して米国で販売を開始するにあたり、FDAによって何がどのように緩和されて、リスクを最小限に抑えるためにFDAはどのようにこの緩和によるリスクの管理しているのかをよく理解している必要があります。本件についてのアドバイスをご希望の方は以下までお問い合わせください。
info@eureka-global.net
2020年3月9日
FDAとFTCは、コロナウイルスの予防や治療を訴求する不正な製品を販売する7社に警告書発行
 米国食品医薬品局(FDA)および連邦取引委員会(FTC)は、詐欺的なコロナウイルス製品を販売している7社に警告状を発行しました。これらの製品は、連邦法に違反する未承認の医薬品として患者の健康に重大なリスクをもたらします。
米国食品医薬品局(FDA)および連邦取引委員会(FTC)は、詐欺的なコロナウイルス製品を販売している7社に警告状を発行しました。これらの製品は、連邦法に違反する未承認の医薬品として患者の健康に重大なリスクをもたらします。
FDAのスティーブン ハーン長官は、FDAは、不正なコロナウイルス製品の販売と宣伝は公衆衛生への脅威であると考えており、公共は連邦機関や医療提供者に相談をするよう求めています。
また、FTCのジョー サイモン議長はコロナウイルスの拡散の可能性については公共には高いレベルの不安感があり、この状況で最も困るのが虚偽の予防や治療クレームで宣伝し消費者を騙す企業であるとしています。 今回の警告文書は、最初のステップであり この種の詐欺に対して徹底的に執行措置を講じていきます、と言っています。
FDAは、このような深刻な病気を予防したり治療すると宣伝している製品により、消費者が必要な治療を遅らせたり中止したりする事で生命にかかわるような深刻な危害につながることを特に懸念しています。
FDAとFTCは、共同でVital Silver, Quinessence Aromatherapy Ltd., Xephyr, LLC doing business as N-Ergetics, GuruNanda, LLC, Vivify Holistic Clinic, Herbal Amy LLC, そしてThe Jim Bakker Show.に警告文書を発行しました。 これらの警告書は、茶、エッセンシャルオイル、チンキ、コロイド銀です。 FDAは以前から、コロイド銀は病気や病状の治療に安全でなく、効果もないと警告していました。 FDAとFTCは、違反を修正するための具体的な手順を記載した回答を48時間以内に提出するよう要求しました。コロナウイルスを防止、治療、または治癒すると不正に主張する製品を販売する企業は、押収または差止命令を含む、法的措置の対象となります。
現在、コロナウイルスを治療または予防するために承認されたワクチンまたは医薬品はありません。ワクチンおよび治療薬は開発中ですが、これらは製品開発の初期段階にあり、安全性または有効性についてはまだ完全とは言えない状況です。 FDAとFTCは、適切な修正を行わなかった企業に対してのフォローアップに加えて、ソーシャルメディア、オンラインマーケット、および消費者からの苦情を引き続き監視し、企業が別の会社名または 別のウェブサイトで販売する事が無いように監視しています。 FDAの複数の機関にまたがるタスクフォースが設立され、コロナウイルスに関連する不正な製品を綿密に監視することに注力しています。 このタスクフォースはすでに主要な小売業者に連絡を取り、コロナウイルスや他の病原体と戦うと主張する不正な製品のオンライン市場を監視するために協力を求めており、既に不正なコロナウイルスに関する詐欺的な製品を30以上削除しています。
2020年3月3日
FDAによる 食品・飲料施設におけるFSMA施行の増加
段階的に導入されてきた食品安全強化法(FSMA)の遵守期限の大部分が過ぎたため、米国食品医薬品局(FDA)は、規制を執行する取り組みを強化してきており、検査違反や警告文発行を通じて、FDAはFSMA規制の施行を徹底させようとしてきました。 2019年の主要な動きを以下にご紹介します。
FSMA規制の積極的な執行開始
FDAの検査データによると、2019年にはFSVP(外国供給業者検証プログラム)を持たない289の輸入業者を召喚しており、その数は2018年の108から増加しました。FDAはまた、ハザード分析およびリスクに基づく予防管理(HARPC)の食品安全計画に問題があるとして、数百の施設を召喚しました。これらの召喚は、HARPC食品安全計画を持っていないことや、管理を必要とするリスクを特定していないこと、または予防管理有資格者(PCQI)が必要な計画書を作成していないこと、など広範囲に及んでいます。
数年前から遵守期限を迎えた規制事項もあり、現状大部分が遵守期限を過ぎているため、FDAはFSMAに関する規則をより厳しく執行していくものとみられます。
意図的な異物混入に関する規制
cFSMAでは、施設は、食品防御計画によって意図的な異物混入から食品を守るための戦略を策定するための有資格者を指定する事を求めています。フルタイムで500人以上従業員がいる施設の施行期限は、2019年7月26日までに、そしてフルタイム従業員が500人未満の企業は、2020年7月26日までに遵守する必要があります。
FDAは、施設が食品防御計画を作成するのを支援するガイダンスをリリースしました。このガイダンスは、計画を作成するプロセスを合理化するための方法が記載されています。
FDAが再審査に係る料金の引き上げを発表
今年、FDAは2020年に実施される再審査の料金を引き上げると発表しました。定期審査の費用はかかりませんが、FSMAの下では、コンプライアンス上問題が合った場合に施設を再審査する際に、FDAは料金を徴収していますが、米国外の施設の料金は1時間当たり282ドルから301ドルへ、国内施設では1時間当たり253ドルから258ドルへと引き上げました。
FDAが予防管理とFSVP違反に対する警告書を発行
FDAは、FSMA違反に関するコンプライアンスの問題がある企業に対して、警告書の発行を開始しました。FSMA違反には、予防管理とFSVPに関するものが最も多く見られます。これらの規制の遵守期限を迎えた当初は、FDAは猶予期間として、食品施設に対しこれらの新しい規則を認識させ理解させることに注力していました。しかし、2019年からはFDAが教育段階から執行段階に移行していることが伺われます。
警告書は、コンプライアンス違反を言及するFDAからの正式なメッセージであり、通常、警告書を発行された施設は15営業日以内に、違反への解決策をまとめて回答する事が求められています。今後もFSMA違反に対するさらに多くの警告書が発行されていくものとみられます。
2020年1月9日
FDA、USDA、EPAによる農業バイオテクノロジー製品に関する共同プラットフォーム
 2020年1月は国家バイオテクノロジー月間であることに鑑みて、2020年1月9日、米国食品医薬品局(FDA)、農務省(USDA)、環境保護庁(EPA)は、バイオテクノロジー規制のための合同ウェブサイトを立ち上げました。このウェブサイトは、農業バイオテクノロジー製品の監督を担当する3省庁に関する情報をまとめ、簡素化する事を目指したもので、トランプ大統領の「農業バイオテクノロジー製品の規制枠組みの近代化に関する大統領令」への対応の一部です。
2020年1月は国家バイオテクノロジー月間であることに鑑みて、2020年1月9日、米国食品医薬品局(FDA)、農務省(USDA)、環境保護庁(EPA)は、バイオテクノロジー規制のための合同ウェブサイトを立ち上げました。このウェブサイトは、農業バイオテクノロジー製品の監督を担当する3省庁に関する情報をまとめ、簡素化する事を目指したもので、トランプ大統領の「農業バイオテクノロジー製品の規制枠組みの近代化に関する大統領令」への対応の一部です。
FDAのスティーブン ハーン長官は、「現在は前例のない科学的革新の時代です。農業バイオテクノロジーは、ダイナミックな新製品を市場に導入することを約束します」と述べました。「FDAは、人間と動物の健康と幸福を保護し、促進するという使命を維持しながら、例えば、新型インフルエンザなどの病気、および、人獣共通感染症または外来動物病に対する感受性を低下させるなど、この分野での柔軟なリスクベースのアプローチの促進に尽力しています。FDAのアプローチは、食料供給の安全性を確保するために、国際的にも評価の高い科学に基づいたレビュー基準と、継続的なリスクに基づく規制へのアプローチとのバランスをとっています。」
バイオテクノロジー規制の合同ウェブサイトでは、バイオテクノロジー製品の連邦審査プロセスについて説明されており、ユーザーは3省庁に質問を提出する事ができます。このウェブサイトのゴールは、イノベーター・開発者により良いサービスを提供し、一方で、アメリカ人が世界で最も安全で手頃な価格の食料供給を享受し続け、バイオテクノロジーのイノベーションの安全な使用についてさらに学んでいく事を確実にすることです。
2019年12月31日
USDAによるバイオ工学食品開示施行
 2016年、米国議会は、全米バイオ工学食品情報公開法を可決しました。この法律が米国農務省(USDA)にバイオ工学食品の強制開示に関する一連の規則を発行することを要求したことから、USDAは2018年に、この新しい基準の実施に関する最終規則を公開しました。
2016年、米国議会は、全米バイオ工学食品情報公開法を可決しました。この法律が米国農務省(USDA)にバイオ工学食品の強制開示に関する一連の規則を発行することを要求したことから、USDAは2018年に、この新しい基準の実施に関する最終規則を公開しました。
この規則は、米国におけるヒトの消費を目的とした食品に対し、バイオ工学成分を含むかどうかを開示することを求めるものです。
新しいラベルを付ける必要がある製品
新しい開示要件は、ヒトが消費することを目的とした食品に適用されます。ペットフードや動物飼料は対象外です。食品の定義には、直接消費される品目と飲食物の成分に使用される品目両方が含まれます。すなわち、果物や野菜などの生の農産物も含まれますし、加工食品(スープ、シリアルなど)、栄養補助食品、加工助剤、および酵素も対象としています。
米国食品医薬品局(FDA)のラベル表示規則の対象となる食品は、バイオ工学開示基準の対象にもなります。ほとんどのアルコール飲料は、FDAのラベル規則の対象にはならないので免除対象ですが、体積で7%未満のアルコールを含むワインや大麦麦芽やホップなしで醸造されたビールなどはFDAのラベル規制対象であるため、バイオ工学開示基準の対象になります。
肉、鶏肉、または卵製品は、最も主要な成分がFDAのラベル表示規制の対象となる食品の成分でない限り、バイオ工学開示基準から免除されます。詳細は下記のリンクをご参照ください。
https://www.federalregister.gov/documents/2018/12/21/2018-27283/national-bioengineered-food-disclosure-standard
バイオ工学食品とは
USDAによると、バイオ工学食品を「試験管内での組換えデオキシリボ核酸(DNA)技術によって改変された遺伝子物質を含み、かつ、従来の品種改良では得られないか、自然界で起こらない遺伝子組み換えがなされた」食品と定義されています。この定義によると、改変された遺伝子物質が検出できない食品は含まれませんので、これに該当する場合は食品施設は遺伝子組み換え物質が検出できないことを確認する記録を保持する必要があります。
例えば、高度に精製された成分は、開示要件の対象にはなりません。これは、加工条件により原材料に存在していたDNAが分解されてしまっているためです。これにより、遺伝子組み換え物質が検出できなくなりますので食品加工施設は、高度に精製された原料の遺伝子組み換え物質が検出不可能なレベルであることを証明する記録を保持しなければなりません。
製品にバイオ工学成分が含まれているかどうか不明な場合には、USDAによるバイオ工学食品一覧表をご参照ください。
免除扱い対象
以下は開示基準から免除されています。
・レストランまたは同様の小売食品店舗で提供される料理
・非常に小規模な食品メーカー(食品の年間販売額が250万ドル未満)
・意図しない又は技術的に避けられないバイオ工学物質が各成分で5%未満存在すること(意図的なバイオ工学物質への許容値はなし)
・バイオ工学生産物を与えられた動物に由来する食品
・USDAよりオーガニックとして認定された食品
コンプライアンス
バイオ工学製品の開示は、製造業者、輸入業者、および特定の小売業者の責任です。小売業者が受け取る前に包装された食品については、製造業者または輸入業者の責任であり、小売業者が食品を包装する場合、その食品は当該小売業者の責任となります。
食品の年間販売額が1,000万ドル以上の対象施設の施行日は2020年1月1日です。食品の年間販売額が1,000万ドル未満の施設の場合、施行日は2021年1月1日です。USDAは、該当する全製品がこの時点までに開示されることを推奨しています。この規則では、2022年1月1日以降、すべての規模の施設でコンプライアンスが必須となり、コンプライアンスに違反すると強制措置が講じられる可能性があります。
2019年10月1日
不適切なクレームの輸入品を'未承認の医薬品'として拘留
 2019年9月、米国食品医薬品局(FDA)は、数多くの製品と企業を輸入警告(インポート・アラート)66-41「米国へ未承認の新薬に対する物理的検査なしの拘留」にリストアップしました。一ヶ月間の更新と追加としては、異例といえる程の数となっています。
2019年9月、米国食品医薬品局(FDA)は、数多くの製品と企業を輸入警告(インポート・アラート)66-41「米国へ未承認の新薬に対する物理的検査なしの拘留」にリストアップしました。一ヶ月間の更新と追加としては、異例といえる程の数となっています。
輸入警告とは、製品がFDA規制に違反している場合に、物理的検査なしに即時勾留(DWPE)対象になったことを一般向けに通知するものです。この輸入警告は、包装またはマーケティングがFDAによって「医薬品」と見なされるクレームがある事を理由として発行されたものです。FDAには、製品がクレームできる内容に関し厳しい規制があります。 いかなる逸脱も違法表示とみなされ、規制措置を講じられます。
一方、クレームが「病気の診断、治療、緩和、処置、または予防」を主張するような内容は、FDAによって「未承認の医薬品」と見なされ、規制対象となります。
輸入警告の対象となった製品の多くは、食品、栄養補助食品、または化粧品として販売されているものにもかかわらず、ラベルのクレームは「医薬品」紛いのクレームをしているものです。例として、栄養食品について「過剰な血糖値を下げるのに役立つ」とか「ストレスを受けた赤血球の柔軟性を高める」などとクレームしているものがあります。このようなクレームは、病気の治療と緩和に関するものとされ、医薬品と見なされます。
医薬品有効成分を含む製品も、FDAによって医薬品と見なされています。ある会社はニコチンパッチを化粧品として販売していましたが、FDAはニコチンパッチをOTC医薬品として規制しています。コンプライアンスの問題を回避するために、米国へ輸出し米国市場に販売する前に成分が規制に準拠しているか調査する必要があります。
FDAによる“ラベル”の定義は、容器、箱、包装に記載されたり貼られている文章やグラフィックのラベルだけでなく、テレビ、ラジオ、印刷物、オンライン広告、製品のウェブサイト、公開された推薦意見など付随するものを全て含み、医薬品紛いのクレームがある場合は違法表示であると見なされますので注意が必要です。
2019年9月17日
動物用食品施設の安全性のための予防管理の最終期限
 食品安全強化法(FSMA)に基づき、動物用の食品を製造、加工、梱包、または保管する施設は、予防管理規則を順守する必要があります。この規則は施設にハザード分析及びリスクに基づく予防管理(HARPC)計画を実施し、サプライチェーンプログラムを策定、維持することを義務付けています。
食品安全強化法(FSMA)に基づき、動物用の食品を製造、加工、梱包、または保管する施設は、予防管理規則を順守する必要があります。この規則は施設にハザード分析及びリスクに基づく予防管理(HARPC)計画を実施し、サプライチェーンプログラムを策定、維持することを義務付けています。
これに関し、非常に小規模な企業を含む食品施設は、米国食品医薬品局(FDA)に適格施設証明(QFA)を提出しない限り、予防管理規則に従う必要があります。2019年9月17日以前から動物用食品を生産している施設は、2019年12月16日までに初期証明を提出する必要があり、一方、この日付以降に生産を開始する場合は、作業開始前に証明を提出する必要があるとされています。FDAによると、非常に小規模な企業を含む適格施設は、2019年10月1日からFURLS (FDA Unified Registration and Listing System: FDA登録、リスティングシステム)を通じてQFAを提出できるようになります。この初期の期限後は、該当施設は偶数年の10月1日から12月31日までの間にFDAに証明を提供する必要があります。
FDAは、非常に小規模な企業を、「動物用食品の製造、加工、梱包を行い販売額と在庫の市場価値が、過去3年間の年間インフレ調整済みで平均で250万ドル未満」と定義しています。QFAとは、当該企業がFDAによる非常に小規模な企業の定義を満たしていることを証明する文書です。
もし非常に小規模な企業がFDAにこの証明を提出しないと、食品安全計画とサプライチェーンプログラムを持つことが必要になります。
現行適正製造基準(cGMP)と予防管理規則の両方とも動物用食品の生産者にとって新しいため、FDAはこれら2つの適用日をずらしました。cGMPは適切な洗浄、機器の維持、害虫駆除などの基本的な食品安全要件をカバーしており、これはあらゆる規模の動物用食品施設が対象となり遵守日は既に過ぎています。
FDAは、今後施設の定期査察中にcGMPおよび予防管理要件の遵守状況を確認していく予定です。施設が12月19日の期限までにQFAを提出せず、免除されていない場合、FDAは施設に適切なHARPC食品安全計画とサプライチェーンプログラムがあることを義務付けていますので、その事が判明した場合は規制上の通知が発行される事になります。
2019年9月17日
FDAによる予防的制御とFSVP違反の警告文書
 食品安全強化法(FSMA)に基づき、米国内または米国外にあり米国輸出を行う食品施設は、ハザード分析及びリスクに基づく予防管理(HARPC)方式に準拠した食品安全計画を持つ必要があります。同法はまた、米国の輸入業者に、すべての食品または原材料について外国供給業者検証プログラム(FSVP)を持つことを義務付けています。これらの規則の遵守期限の大部分は過ぎており、FDAは、施設の検査中にこれらの規則の執行を増やしてきており今後も引き続き執行を強化していく予定です。
食品安全強化法(FSMA)に基づき、米国内または米国外にあり米国輸出を行う食品施設は、ハザード分析及びリスクに基づく予防管理(HARPC)方式に準拠した食品安全計画を持つ必要があります。同法はまた、米国の輸入業者に、すべての食品または原材料について外国供給業者検証プログラム(FSVP)を持つことを義務付けています。これらの規則の遵守期限の大部分は過ぎており、FDAは、施設の検査中にこれらの規則の執行を増やしてきており今後も引き続き執行を強化していく予定です。
最初の期限後、FDAは施設に新しい規則を認識させ理解させるために、施設の教育に注力してきました。そしてFDAは施設検査中にFSMA規制の違反を積極的に言及してきています。実際、FSVPを策定できていないことが、2018年で最も多く見られた違反となっています。
FDAは2017年9月18日以降、食品安全計画を策定する必要性を強調してきています。期限からある程度の時間が経過した後、FDAは施設に適切な食品安全計画があり実装されているかを確認していきます。完全な食品安全計画とは、食品の生産に対する潜在的な生物学的、化学的(放射線を含む)、および物理的な危険をすべて特定し、これらの危険を阻止し排除するための管理を確立しているものです。
潜在的なリスクの管理を確立する際には、計画の一部を省いたり、あらゆるリスクを特定できていない事は問題です。例えば、潜在的な環境ハザードやアレルゲン管理の要素も含める必要があります。また、モニタリング、是正措置、および管理の検証に関する文書記録を維持することが要求され、適切な書面による記録がない場合は、食品安全計画そのものが存在しない、と見なされます。食品安全計画の要件のいずれかが不十分である場合、または遵守していない場合は、警告文書が発行されます。
施設の食品安全計画を整備し、それを継続的に実行し、常にアップデートしていく事が求めらています。計画は定期的に、または問題が発生した場合に再評価される必要があります。また、従業員全員が、計画の実装に必要な事項、役割や責任について訓練されている必要があります。
FSVP(外国供給者検証プログラム)違反
米国の輸入業者は、サプライヤーの製品が米国の食品安全基準を満たしていることを検証および承認する事が義務付けられています。輸入業者は、承認したサプライヤーからのみ製品を輸入する事を文書化した手順を確立し、それに従います。輸入業者は、輸入する製品が予防管理規則や現行適正製造基準(cGMP)などFDAの該当規制に準拠していることを確認する責任があります。また、これらは輸入される個々の製品ごとに策定される必要があります。 サプライヤーについては、最低3年に1回は再評価されなければなりません。
FDAは最近、FSVP規則に準拠できていない事による、初めての警告書を発行しました。FDAによると、以前の検査で不備があった輸入業者の再検査や、公衆衛生上の深刻なリスクをもたらすようなFSVPの不備が見つかった場合に即座に対応するなど、FSVPへのコンプライアンスを徹底させるためのさらなる措置を講じる予定です。施設はFSVP違反の警告書を受け取った場合、15日以内に警告書に対しどのように違反を解消するかについて回答する必要があります。FSVPの違反は、輸入警告99-41が課されます。
2019年05月09日
冷凍ベリーのサンプリングの実施
 食品安全近代化法に基づく微生物監視サンプリング*の一環としてFDAは、冷凍ベリーのA型肝炎ウイルスとノロウイルスを対象にサンプリングを実施しています。
2018年11月から約18ヶ月間、FDAは国内の小売用の冷凍ベリーのパッケージのサンプルを加工業者、流通センター、倉庫、および小売業から収集しています。輸入品冷凍ベリーについても入国港、輸入倉庫、保管施設からサンプルを収集しておりFDAは全部で2,000のサンプルを集めてテストすることを計画しています。冷凍ベリーは多くの食品の原料として使用されており、健康的な食事パターンの重要な部分を占めています。
冷凍ベリーはパイやその他の焼き菓子に使用されていますが、フルーツサラダやスムージーは生で消費されており、食中毒の発生と関連する可能性があります。 FDAは、米国内で1997年から2016年までの間に、冷凍ベリーに関するA型肝炎ウイルスの発生事件が3回とノロウイルスの発生事件が一回あったとしています。
食品安全近代化法に基づく微生物監視サンプリング*の一環としてFDAは、冷凍ベリーのA型肝炎ウイルスとノロウイルスを対象にサンプリングを実施しています。
2018年11月から約18ヶ月間、FDAは国内の小売用の冷凍ベリーのパッケージのサンプルを加工業者、流通センター、倉庫、および小売業から収集しています。輸入品冷凍ベリーについても入国港、輸入倉庫、保管施設からサンプルを収集しておりFDAは全部で2,000のサンプルを集めてテストすることを計画しています。冷凍ベリーは多くの食品の原料として使用されており、健康的な食事パターンの重要な部分を占めています。
冷凍ベリーはパイやその他の焼き菓子に使用されていますが、フルーツサラダやスムージーは生で消費されており、食中毒の発生と関連する可能性があります。 FDAは、米国内で1997年から2016年までの間に、冷凍ベリーに関するA型肝炎ウイルスの発生事件が3回とノロウイルスの発生事件が一回あったとしています。
イチゴ、ラズベリー、ブラックベリーは、適切な手指衛生を使用していない感染した労働者によって取り扱われたり、または農業用水や農地が汚染されていると汚染された製品となってしまいます。 凍結すると果実は保存する事ができますが、低温で生き残ることができるウイルスを殺菌する事はできません。
FDAが検体中にA型肝炎ウイルスまたはノロウイルスを検出した場合、当局はその所見を会社に通知し、公衆衛生を保護するための適切な措置を講じるために会社と協働します。更に、会社を輸入警告リストに載せたり、リコールを監視したり、または公的に警告を発するための措置を講じます。
FDAは、サンプリング結果を四半期毎に19〜20年度のFrozen Berries Assignmentページに掲載し、最終的には分析レポートを発行します。
ご参考:
食品安全近代化法に基づく微生物監視サンプリング*
FDA食品安全近代化法の中核をなす、食品安全に対するFDAのリスクベースおよび予防的アプローチの一環として、2014年からサンプリング進めていくための新しいアプローチを開始しました。監視サンプリングの目的は、汚染された製品が消費者に届かないようにし、危険性についての理解を深めることです。FDAは、収集/テストされたサンプルの総数、収集日、サンプルの種類、陽性サンプルについて検出された病原体など、テスト結果に関する情報をWeb上で公開します。サンプリングアプローチ、サンプル対象となった食物、データ、リポートの詳細は以下の通りです。
新しいサンプリングアプローチでは、FDAは約18ヶ月に亘りターゲットとする食品の数多くのサンプルを収集し、意思決定に役立つようなデータを入手できるようにします。 このアプローチは、出所、品種、季節など、調査結果が陽性のものに共通の要因があるかどうかをFDAが判断するのに役立ちます。過去の微生物監視サンプリングに対するアプローチは、長年にわたり、様々な商品について少数のサンプルを収集していました。初年は、もやし、新鮮なアボカド、生乳チーズ(60日齢)に焦点を当て、各商品につき800以上のサンプルを集めて、サルモネラ菌、リステリア菌および大腸菌O157:H7についてテストしました。2016年度はきゅうりと唐辛子のサンプルを各1,600個のサンプルとして採取し、サルモネラ菌と大腸菌O157:H7のの試験を行いました。 更にホットペッパーについては志賀毒素産生性大腸菌のためのテストもしました。 2018年度は、新鮮なハーブ、特にバジル、パセリ、およびコリアンダーをサンプリングしサルモネラ菌、志賀毒素産生性大腸菌の検査、および夏季のシクロスポラ・カヤタンシスの検査を実施しました。また、2018年度には加工アボカドとワカモレをサンプリングしサルモネラ菌とリステリア菌の検査しています。
FDAは、サンプル収集期間中に生成されたデータまたは結果を評価し、そのデータを使用して短期および長期の意思決定を通知し、これらのデータセットを作成することにより食品安全の問題点を明確化しより安全なシステムを強化しようとしています。 FDAは陽性サンプルがほとんど見られない場合、サンプリング数を減らしたり、または傾向が特定された場合、例えば、陽性サンプルが特定の地理的地域、特定の施設、または特定の季節に由来する場合などは、より的を絞ったサンプリングを実施する等の方法を取ります。 また、フォローアップ検査や、州または国際的な規制当局と協力して是正措置を講じ、予防的管理を実施したり、新規のガイダンス発行や、既存のガイダンスの強化、積極的な情報共有を行います。
2019年04月16日
DMHAとフェニブットを含むサプリメントに警告文書発行
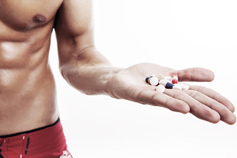 FDAは法律に違反しているダイエタリー・サプリメントの製造会社に12の警告書を発行しました。
FDAは法律に違反しているダイエタリー・サプリメントの製造会社に12の警告書を発行しました。
FDAは、製品がDMHAを含むと表示されている栄養補助食品とし販売している会社向けに9つの警告レターを発行しました。 DMHAは多くの栄養補助食品に含まれており、スポーツパフォーマンスや減量に有効として販売されています。
FDAは、DMHAについて新しいサプリメントの原材料を販売する前に必要なNew Dietary Ingredient Notification(新栄養成分通知)が受領されていない「新しい食成分」であるか、または安全でない食品添加物であるとしています。 また、FDAは、DMHAを含む栄養補助食品はadulterated(粗悪品)であるとみなしています。DMHAは次の名称でも知られています。
- 1,5-Dimethylhexylamine
- 1,5-DMHA
- 2-amino-5-methylheptane
- 2-amino-6-methylheptane
- 2-aminoisoheptane
- 2-Heptylamine, 6-methyl-
- 2-Isooctyl amine
- 2-Metil-6-amino-eptano
- 6-Amino-2-methylheptane
- Amidrine
- Octodrine
- Vaporpac
FDAはまた、phenibut(フェニブト)を含むと表示し栄養補助食品として販売している会社向けに3つの警告レターを発行しました。 フェニブートを含む栄養補助食品は、睡眠補助薬などの用途として市販されています。フェニブートは連邦食品医薬品化粧品法(FD&C法)に基づく食物成分の定義を満たしていないとし、栄養補助食品として販売する事は虚偽表示行為にあたるとしています。フェニブートは以下の名前でも知られています。
- fenibut
- phenigam
- PhGaba
- Phenigamma
- Phenygam
- 4-Amino-3-phenylbutanoic acid
- β-(aminomethyl)benzenepropanoic acid
- beta-(Aminomethyl)hydrocinnamic acid
- β-phenyl-γ-aminobutyric acid
会社は、警告文書を受け取った日から15営業日以内に、製品を法律に準拠させるための具体的な手順を回答する必要があります。 警告文書はまた、製品の販売を直ちに中止しない場合、FDAは執行措置を講ずることができるとしています。
詳細は以下のリンクをご参照ください。
2019年03月27日
FDAは食物繊維に関する市民嘆願書を交付
米国食品医薬品局は、「架橋リン酸化RS4」を食物繊維の定義に加えることを提案する意向であることを発表しました。 これはMGP Ingredients Inc.からの嘆願書に応えたもので、栄養分析表など食品のラベル上で宣言することができる食物繊維は、植物由来であり自然に存在し、変化が加えられていない可溶性および不溶性炭水化物であり、ヒトの健康に有益な生理学的効果をもたらすものとされています。
FDAは 架橋リン酸化RS4が血糖値を上昇させる炭水化物を含む食事後に、インスリン値を下げるのに有効であるという科学的証拠に基づき、決定しました。
この最新の通知を含め、16種類の非消化性炭水化物が食物繊維の定義に含まれるか、FDAがその定義に追加することを提案するとしています。これらの食物繊維のうち7つは、栄養成分表示の最終規則で食物繊維の定義を満たすものとして既に識別されています。 他の9つの食物繊維に関してはFDAが食物繊維の規制の定義に正式に加える規則制定が完了するまでは、栄養分析表等ラベルの食物繊維の記載に関して製造業者が任意に決める事を可能としています。
https://www.fda.gov/food/cfsan-constituent-updates/fda-grants-citizen-petition-dietary-fiber
2018年12月13日
2018年度のFDAによる食品施設検査の結果
FDAによる2018年度(2017年10月1日から2018年9月30日まで)の検査結果は以下の通りです。
| 規制番号 | 内容 | 説明 | 頻度 |
|---|---|---|---|
| 21 CFR 1.502(a) |
FSVP | FSVPが作成されていない。 | 278 |
| 21 CFR 123.11(b) |
衛生監視 | 最新の適正製造基準への適合を保証するのに十分な頻度で衛生条件および慣例を監視していない。例えば氷を製造するために使用される水を含む、食品または食品に接触する水の安全性や食品に接触する機材の清潔さ、手洗い、手の消毒、トイレ設備の維持、食品包装材の汚染混入防止。毒性のある化学物質物の適切な表示、保管や使用、従業員の健康状態の管理、害虫の排除等。 | 188 |
| 21 CFR 117.35(c) |
効果的な有害生物排除の欠如 | 加工区域から害虫を除外する、または害虫による敷地内の食品の汚染から保護するための効果的な対策が講じられていない。 | 183 |
| 21 CFR 117.80(c) |
製造、プロセス、パッキング、保存のコントロール | 生産の手順がいかなる汚染源からの汚染の原因にならない事を確実にするために、すべての妥当な予防策がとられているとは言えない。 | 175 |
| 21 CFR 117.35(a) |
施設/衛生 | 建物、備品、その他の物理的設備が衛生的な状態に維持できていない。 | 167 |
| 21 CFR 117.10 |
従業員 | 人事慣行に関連した合理的な措置および予防措置を講じているとは言えない。 | 162 |
| 21 CFR 117.40 |
機器や道具 - デザインやメンテナンス | アレルゲン交差や汚染から保護するために、機器や器具は適切に清浄またはメンテナンスされるように設計および構築されているとは言えない。 | 158 |
| 21 CFR 117.37 |
衛生的な施設とそのコントロール | 施設に十分な衛生的設備と保存施設があるとは言えない。 | 143 |
| 21 CFR 117.20(b) |
施設建設上のデザイン | 施設がメンテナンスや衛生管理を容易に行えるように設 計、建設されたものとは言えない。 |
140 |
| 21 CFR 123.6(b) |
HACCP計画の導入 | HACCP計画にリストされているモニタリング、記録管理、検証の手続きが導入されていない。 | 136 |
詳細は以下のリンクをご参照。
https://www.fda.gov/ICECI/Inspections/ucm250720.htm
2018年12月7日
FDA、アボガド及び唐辛子のサンプリング結果に関する報告書を公表
 FDAは、各商品にどれだけの頻度で有害なバクテリアが見つかるかを判断するために、新鮮なアボカドと唐辛子をサンプリングした2つの報告書を発表しました。これらのサンプリング調査は、食品の安全性を確保し、汚染された製品が消費者に届くのを防ぐためのFDAによる継続的な取り組みの一つです。
FDAは、各商品にどれだけの頻度で有害なバクテリアが見つかるかを判断するために、新鮮なアボカドと唐辛子をサンプリングした2つの報告書を発表しました。これらのサンプリング調査は、食品の安全性を確保し、汚染された製品が消費者に届くのを防ぐためのFDAによる継続的な取り組みの一つです。
2014年、FDAはサルモネラ菌、リステリア菌、大腸菌(E.coli)のような一般的な環境病原菌が食品中にどれほど頻繁に含まれているかについて知り、食品中の微生物汚染を減らすための方法をFDAが特定することを目的に、新しいサンプリングプログラムを導入しました。このプログラムに関する追加情報は、FDA食品安全・応用栄養センター(CFSAN)のディレクターであるSusan MayneとCFSANのコンプライアンスオフィスのディレクターであるWilliam
Correllによる「FDA Voices」ブログで説明されています。
唐辛子サンプリングの研究については、FDAはサルモネラ菌、大腸菌O157:H7、およびその他の種類の志賀毒素産生大腸菌(STEC)について、国内および輸入唐辛子サンプルを収集、検査、および分析しました。検査した1,615の唐辛子サンプルのうち、46(2.85%)がサルモネラ菌陽性であり、1個はSTEC陽性でしたが、そのSTEC株は重症疾患を引き起こさないことが明らかになりました。
丸ごとの新鮮なアボカドサンプリングの研究については、FDAは、サルモネラ菌およびリステリア菌について、1,615の国内および輸入アボカドサンプルを収集、検査、および分析した結果1,615のサンプルのうち、12(0.74%)がサルモネラ菌陽性でした。
リステリア菌検査に関しては、FDAは主にアボカド果肉サンプル(果肉が人の食する部分)、および果皮のサンプルを検査しました。1,254のアボカド果肉サンプルのうち、3(1%よりはるかに少ない)がリステリア菌陽性だったのに対し、361のアボカド果皮サンプルのうち、64(17.73%)がリステリア菌陽性という結果になりました。FoodSafety.govは消費者に対して、切る前や食べる前にすべての農産物を洗うことを勧めています。
FDAが国内製品に唐辛子またはアボカドの陽性サンプルを発見した場合、FDAは指示通りリコールを実施するために責任を有する会社と協力し、良好な農作業および適正製造基準に準拠していることを確認するため、引き続き生産者および梱包業者を検査しました。FDAが輸入製品に唐辛子またはアボカドの陽性サンプルを発見した場合、FDAは陽性に関連する全製品の入国を拒否し、追加の製品が米国に入らないように企業に輸入警告(Import Alert)を発行しました。
FDAのサンプリングプログラムに関する追加情報や、丸ごとの新鮮なアボカドと唐辛子の報告を読むには、「微生物学的監視サンプリング」をご覧ください。
唐辛子とアボカドのサンプリング報告書に加えて、FDAは新鮮なハーブ、グアカモーレと加工アボカドに関する継続中のサンプリング研究に関する四半期ごとの更新を掲載しました。
2018年10月1日時点で、FDAはこれらの製品に関連する潜在的な病原菌の継続的なモニタリングの一環として683の新鮮なハーブサンプル(国内407、輸入276)および474の加工アボカドまたはグアカモーレサンプル(国内386、輸入88)を検査しました。新鮮なハーブサンプルのうち、9はサルモネラ菌陽性(国内4、輸入5)、
6はSTEC陽性(国内2、輸入4)と判定されましたが、さらなる特性評価により、そのSTECは重症疾患を引き起こすものではない事がわかりました。そして4はサイクロスポラ陽性(国内2、輸入2)と判定されました。
FDAが検査した新鮮なハーブサンプルのいずれにおいてもO157は検出されませんでした。加工アボカドまたはグアカモーレサンプルのうち、11はリステリア菌陽性(国内9、輸入2)と判定されました。加工アボカドまたはグアカモーレのいずれのサンプルにおいてもサルモネラ菌は検出されませんでした。
詳細は以下のリンクをご参照ください。
• Microbiological Surveillance Sampling: FY16–17 Hot Peppers
• Microbiological Surveillance Sampling: FY14-16 Whole Fresh Avocados
2018年11月19日
オリーブ油、ひまわり油、キャノーラ油などの食用油中のオレイン酸に関する健康強調表示について
 米国食品医薬品局(FDA)は、オリーブ油、ひまわり油、キャノーラ油などの食用油でオレイン酸を摂取することにより、冠状動脈性心疾患のリスクを低減させるかもしれないという、限定的健康強調表示を裏付ける確かな証拠があると判断しました。入手可能な科学的証拠を系統的にレビューした結果、FDAは現在、食用油(1食当たり少なくとも70%のオレイン酸を含む)中のオレイン酸の消費量と冠状動脈性心疾患リスクの減少との関係を特徴付ける2つの限定的健康強調表示の使用に関する執行裁量権を行使する意向です。オレイン酸は一価不飽和脂肪酸で、飽和脂肪酸を多く含む油脂に代用されると冠状動脈性心疾患のリスクを減らすことができます。
米国食品医薬品局(FDA)は、オリーブ油、ひまわり油、キャノーラ油などの食用油でオレイン酸を摂取することにより、冠状動脈性心疾患のリスクを低減させるかもしれないという、限定的健康強調表示を裏付ける確かな証拠があると判断しました。入手可能な科学的証拠を系統的にレビューした結果、FDAは現在、食用油(1食当たり少なくとも70%のオレイン酸を含む)中のオレイン酸の消費量と冠状動脈性心疾患リスクの減少との関係を特徴付ける2つの限定的健康強調表示の使用に関する執行裁量権を行使する意向です。オレイン酸は一価不飽和脂肪酸で、飽和脂肪酸を多く含む油脂に代用されると冠状動脈性心疾患のリスクを減らすことができます。
FDAは、以下の限定的健康強調表示について執行裁量権を行使する予定です。
1.「支持的だが決定的ではない科学的証拠によると、飽和脂肪酸の多い油脂の代わりに、オレイン酸を多く含む油を毎日大さじ約1.5杯(20g)摂取すると、冠状動脈性心疾患のリスクを減らす可能性があります。この潜在的有効性を達成するために、オレイン酸含有油の摂取により一日の総カロリー摂取量を増やすべきではありません。1回分の[x]油で、[x]gのオレイン酸([x]gの一価不飽和脂肪酸)が得られます。」
2.「支持的だが決定的ではない科学的証拠によると、オレイン酸を多く含む油を毎日大さじ約1.5杯(20g)摂取する
と、冠状動脈性心疾患のリスクを減らす可能性があります。この潜在的有効性を達成するために、オレイン酸含有油
は、飽和脂肪酸のより多い油脂から代替されるべきでありますが、これにより一日の総カロリー摂取量を増やすべきではありません。1回分の[x]油で、[x]gのオレイン酸([x]gの一価不飽和脂肪酸)が得られます。」
その限定的健康強調表示はCorbion Biotech,
Inc.によって提出された請願に対する回答です。限定的健康強調表示は信頼できる科学的証拠によって裏付けられていますが、FDA認可の健康強調表示のために必要な、より厳格な「重要な科学的合意」基準は満たしていません。そのため、その表示を裏付ける科学的証拠のレベルが正確に伝わるように、それらの表示は免責条項またはその他の限定的な文言を伴わなくてはなりません。FDAが限定的健康強調表示の使用のために強制裁量権を行使する意図は、その表示を裏付ける製品が、請願への回答である執行裁量権に関するレターにおいてFDAが規定した要素と一致する限り、FDAはその使用に反対するつもりはないということを意味します。
オレイン酸は、食用油、肉(牛肉、鶏肉、豚肉など)、チーズ、ナッツ、ひまわりの種、卵、パスタ、牛乳、
オリーブ、アボカドなど、多くの食料源に天然に含まれています。 Corbion Biotechの請願では、1食分あたり少なくとも70%のオレイン酸を含むものとして、以下の食用油が特定されています。1)高オレインひまわり油、2)高オレインベニバナ油、3)高オレインキャノーラ油、4)オリーブ油、5)高オレイン藻類油。
詳細は以下のリンクをご参照ください。
• FDA Response to Petition for a Qualified Health Claim for Oleic Acid in Edible Oils and Reduced Risk of Coronary Heart Disease
• Statement from FDA Commissioner Scott Gottlieb, M.D.
• Questions and Answers on Health Claims in Food Labeling
• Qualified Health Claims: Letters of Enforcement Discretion
• Guidance for Industry: Evidence-Based Review System for the Scientific Evaluation of Health Claims
2018年10月5日
FDA、食品添加物リストから7種類の合成香料を削除
FDAは、2件の食品添加物申請に応じて食品添加物規制を改正し、合計7種類の合成香料及び旨味調味料(アジュバント)の使用をもはや認めないと発表しました。乳がん基金、環境衛生センター、食品安全センター、公益科学センター、消費者組合、環境防衛基金、環境ワーキンググループ、子供の環境改善(Improving Kid's Environment)、天然資源保護協議会、環境的公正のため活動団体(WE ACT for Environmental Justice)、及びJames
Huff氏によってFDAに提示されたデータはこれらの合成物質のうち6つが、研究条件下において動物実験で癌を引き起こしたことを示す、としてFDAは決定を下しました。7つ目の合成香料については、もはや業界では使用されないため、リストから除外されました。
6つの香料には、合成由来のベンゾフェノン、アクリル酸エチル、オイゲニルメチルエーテル(メチルオイゲノール)、ミルセン、プレゴン、およびピリジンが含まれます。これらの物質は、連邦食品医薬品化粧品法(FD&C法)のデラニー条項(FD&C法のセクション409(c)(3))により食品添加物規制から除外されました。1958年に制定されたこの条項は、いかなる服用量であってもヒトまたは動物において癌を誘発することが判明している食品添加物の使用についてFDAは承認できないとするものです。
デラニー条項に従ってFDAはこれらの合成香料の食品添加物規制を改正していますが、FDAの厳密な科学的分析では、使用用途の条件下では公衆衛生上の危険はないという決定を下しています。この申請の主題である合成香料は、通常、米国市場で入手可能な食品中に使用される量が非常に少なく、それらの使用による、暴露は微量でありリスクは非常に低いとしています。これらの物質のFDAによる最近の暴露量の評価は、使用用途の条件下で公衆衛生上のリスクがあることを示してはいません。それは、申請者はこれらの物質を動物に対して大量に暴露した条件下において癌を引き起こしたという証拠を示しているためです。従って、FDAは法律上の判断で、これら6つの合成香料の使用許可を取り消すだけであるとしています。FDAは、これらの物質が実質上現在の使用用途下では安全であると結論づけています。
これらの合成物質と同様の物質が、自然に食品中や食品に風味付けするために使用される天然由来の物質に存在しています。これら合成香料およびアジュバントの使用をFDAが取り消すことにより、自然に同等の物質を含む食品または
「天然由来の香料」と分類される香料の法律上の扱いに影響を及ぼすことはありません。
ベンゾフェノンが動物に癌を引き起こすという申請者から出された証拠に基づき、FDAは食品と接触し繰り返し使用されるようなゴム製品の可塑剤としての使用もできないよう食品添加物規制を改正しました。
更に、FDAはスチレン情報研究センターからの別の食品添加物申請を許可し、合成香料やアジュバントとしてのスチレンの使用を認めないように食品添加物規制を改正します。これは産業界がスチレンの使用を断念したためです。
他の6種類の合成香料については、企業が適切な代替成分で製品のフォーミュレーションを改良するため、FDAは連邦官報の規則の公布から24ヶ月の猶予期間を与える予定です。
2018年10月1日
2016年度の農薬分析の結果、5年間一貫した傾向を示す
 米食品医薬品局(FDA)は、2016年度残留農薬モニタリングプログラムの結果を発表しました。FDAは、合計7,413のサンプルを対象に711種類の農薬と工業化学物質を試験しましたが、結果は過去の年度の結果と一致しており、サンプルの大部分は、米国環境保護庁(EPA)によって設定された許容範囲以下でした。
米食品医薬品局(FDA)は、2016年度残留農薬モニタリングプログラムの結果を発表しました。FDAは、合計7,413のサンプルを対象に711種類の農薬と工業化学物質を試験しましたが、結果は過去の年度の結果と一致しており、サンプルの大部分は、米国環境保護庁(EPA)によって設定された許容範囲以下でした。
2016年度に試験された農薬では、国産品2,670サンプルのうち99%以上、そして輸入食品4,276サンプルのうち90%が連邦政府の残留農薬基準に適合しているという結果でした。また、52.9%の国産品および50.7%の輸入品の食品サンプルで、検出可能なレベルの残留農薬は検出されませんでした。サンプルは、EPA基準を超える残留農薬を有する場合、EPAの基準が確立されていない農薬を有する場合、または基準の免除が確立されていない残留農薬を有する場合、違反となります。
また、動物飼料については、採取された国産動物飼料242のサンプル中43.0%、輸入動物飼料の225のサンプル中の54.7%で、検出可能なレベルの残留農薬がないという結果でした。動物飼料サンプルの2%未満が違反する残留農薬を含むという結果でしたしたが、違反のほとんどは、基準が確立されていない農薬が含まれているというものでした。
2016年度にFDAは初めて、トウモロコシ、大豆、牛乳、卵の4つの作物でグリホサートとグルホシネートの新たな試験法を用いて特別な研究を行いました。グリホサートとグルホシネートを試験した760サンプル(内訳は、トウモロコシ274、大豆267、牛乳113、卵106)のうち53.7%は残留農薬が検出されませんでした。牛乳および卵のサンプルのいずれも、検出可能なグリホサートまたはグルホシネートの残留物を有しておらず、トウモロコシおよび大豆サンプル中に検出されたすべての残留物は、EPAによって設定された許容範囲未満でした。
FDAが国産食品中の違反サンプルを特定した場合、栽培者/製造業者に警告書が発行される他、食品を市場から取り除くための押収、違反の原因を是正するための差し止め命令といった行為がとられる可能性があります。輸入食品で違反サンプルが特定されると、出荷は米国の商取引へ入ることを拒否され、企業名はインポートアラートに記載されます。これにより将来の出荷も違反する可能性があるFDAが判断した場合、物理的検査なしで食品を勾留 (DWPE:
物理的検査なしに即時留置)することができます。
農薬は作物の収量に悪影響を与える害虫と戦うため使用されますが、微量の農薬、または農薬の化学的残留物が一部食品に残る可能性はあります。FDAの役割は、食品に残留する農薬が、適用可能な連邦の安全基準を遵守していることを確実にする事です。
FDAは、残留農薬に対するEPAの基準を強化するために3重の戦略を採用しています。まず、残留農薬モニタリングプログラムでは、FDAは広範な国産品および輸入品をモニターしています。更にFDAは、グリホサートおよびグルホシネートの場合と同様に、関心のある作物または農薬の集中サンプリングの実施も行います。そして、これらの2つの規制アプローチに加えて、FDAは、平均的な米国の食事中の汚染物質および栄養素をモニターするプログラムであるトータルダイエットスタディ(TDS)において、摂取される食品中の残留農薬レベルをもモニターしています。
FDAは、食品に安全でない残留農薬が含まれている事が無いようにする責任を、EPAおよび米国農務省と共有しています。この報告書の所見では、FDAによって測定された残留農薬のレベルが総じてEPAの許容量以下であり、それゆえに公衆衛生上懸念がないレベルであることを示しています。
2018年9月6日
微生物を含む食物サプリメントの表示に関するガイダンス案をFDAが発行
 米国食品医薬品局(FDA)は、プロバイオティックスなど生きた微生物成分を含む栄養補助食品(サプリメント)を製造、販売、または流通させる企業に対するガイダンス案を発行しました。このガイダンス案では、企業がサプリメントの成分表示する際に、規制によって義務付けられている重量による定量的な量の表示に加え、コロニー形成単位(CFUs)での生菌の量について表示することを許可する施行裁量権を行使するとしています。
米国食品医薬品局(FDA)は、プロバイオティックスなど生きた微生物成分を含む栄養補助食品(サプリメント)を製造、販売、または流通させる企業に対するガイダンス案を発行しました。このガイダンス案では、企業がサプリメントの成分表示する際に、規制によって義務付けられている重量による定量的な量の表示に加え、コロニー形成単位(CFUs)での生菌の量について表示することを許可する施行裁量権を行使するとしています。
FDAは、CFUsは生きている微生物食品成分の量について有用な情報を提供するものとみています。企業に対してサプリメント成分表示内にCFUsを明記することは、消費者が各製品の生きた微生物の量を明確に知り、製品を比較するのに役立つとみています。
FDAは、21 CFR 101.36を改正しプロバイオティクス成分を重量ではなくCFUsで表示するように要請した国際プロバイオティクス協会からの請願を却下しました。差し当たり、重量による定量的な量に加え、コロニー形成単位(CFUs)での生菌の量について明示することで、消費者および医療従事者に有用な情報を提供する事ができるとしています。
2018年6月
食物繊維の定義に非消化性炭水化物8種類を追加
2018年6月に発表されたガイダンス文書によると、FDAは新たに以下の8つの単離または合成非消化性炭水化物を栄養成分表の表記上、食物繊維として含める意向を発表しました。
- 混合植物細胞壁繊維
- アラビノキシラン
- アルギン酸塩
- イヌリンおよびイヌリン型フルクタン
- 高アミロースデンプン
- ガラクトオリゴ糖
- ポリデキストロース
- 耐性マルトデキストリン/デキストリン
食品栄養素およびサプリメントのラベル最終規則の2016年の改訂版が発表される以前は、FDAは「食物繊維」について定義していませんでした。同規則の下では、単離または合成非消化性炭水化物が生理学的利益を有するとFDAが判断したもののみを食物繊維とする、と定義されています。この要件を満たしている7つの単繊維または合成繊維と呼ばれる食物繊維は以下の7つでした。
- β-グルカン可溶性繊維
- オオバコの殻
- セルロース
- グアーガム
- ペクチン
- ローカストビーンガム
- ヒドロキシプロピルメチルセルロース
FDAは26の単離または合成非消化性炭水化物についての請願書および科学文献を検討した結果、この度8つの炭水化物が必要な生理学的利益をもたらすと判断し食物繊維に加える事としました。
食品業界は、FDAの新しい食物繊維の定義により、既にラベルに記載されている繊維が除外され、食物繊維に関する栄養成分表示や健康強調表示を行う事を制限されるのではないかと懸念していました。例えば、「良い食物繊維源(good source of fiber)」、「食物繊維含有(contain fiber)」または「食物繊維提供(provide fiber)」と表示するには、慣習的に消費される一日当たりの基準値(RACC)28gに対し、その製品の繊維含量は一日摂取量すべきの量の10~19%(2.8~5.3g)なければなりません。しかし、FDAが上記の8つの繊維を含めることにより、より多くの食品製造業者が改定後のラベル要件の下で食物繊維についてのクレームを行うことが可能になるとみられます。
上記の変更は、FDAの新しいラベル規則のコンプライアンス適用日に有効となります。年間の売上が1000万ドル以上の食品メーカーは2020年1月1日までに、1000万ドル未満の食品メーカーは、その1年後が期日となります。
2018年4月
FDAはサプリメントに含まれる高度に濃縮されたカフェインを不純物扱い
 2018年4月発表の米国食品医薬品局(FDA)のガイダンス文書によると、サプリメントとして販売されている特定の純粋、または高濃度のカフェイン製品を、連邦食品、医薬品および化粧品(FD&C)法の下で「Adulted―不純物」とし、米国市場で販売することを禁止するとしています。FDAは、消費者向けに販売されている高濃度の粉末または液体のカフェインサプリメントが、ラベル上に記載されている使用条件下で重大な危険性をもたらすものとしています。
2018年4月発表の米国食品医薬品局(FDA)のガイダンス文書によると、サプリメントとして販売されている特定の純粋、または高濃度のカフェイン製品を、連邦食品、医薬品および化粧品(FD&C)法の下で「Adulted―不純物」とし、米国市場で販売することを禁止するとしています。FDAは、消費者向けに販売されている高濃度の粉末または液体のカフェインサプリメントが、ラベル上に記載されている使用条件下で重大な危険性をもたらすものとしています。
これらのサプリメントの多くは、ごく少量で摂取するか、消費する前に希釈することを意図しておりラベルでの使用方法より、多くの量を消費しないよう促す警告文が表示されます。しかし、FDAは単純な測定誤差が、毒性または致死量のカフェインを摂取する可能性があると主張し警告しています。
例えば、小さじ一杯の純粋または高濃度の粉末状カフェイン製品は約3200mgのカフェインを含み、毒性用量(1200mg)の約2.5倍に相当すると説明しています。これらの製品の安全な服用量は、通常、小さじの1/16である(200mg)以下ですが、最小標準キッチン測定スプーンは、通常、ティースプーンの1/4であり800mgのカフェインが含まれる事になります。このように単純な測定誤差により毒性用量を上回る摂取をもたらす可能性があるとしています。
FDAはすべてのカフェイン入りサプリメントを不純物扱いしている訳ではありません。予め安全な量が測定されていたり、予め希釈された安全な量のカフェインを含むカプセル、錠剤、パケット、および希釈されたカフェインを含んでいるカフェイン・サプリメントについては今回は問題視していません。このような製品は、消費者が安全な量を正確に測定してから消費する必要性はないため、通常、毒性または生命を脅かす症状をもたらす事はないとは考えられています。
このため製造会社や販売会社は、カフェインのサプリメントについては上記の事を考慮してパッケージし、ラベルを付けるようにして対応する必要があります。このような事が順守されていない場合は、FDAからの警告や輸入拒否発行などにより、企業やブランドの評判を損なう可能性があります。
2018年2月
添加された糖分について
 食品栄養素およびサプリメントのラベル最終規則の2016年の改訂版の一部として食品、飲料、および栄養補助食品には、「添加された糖分—Added Sugar」の表記が必要とされています。
食品栄養素およびサプリメントのラベル最終規則の2016年の改訂版の一部として食品、飲料、および栄養補助食品には、「添加された糖分—Added Sugar」の表記が必要とされています。
原則として、1食分に1グラム以上の糖分が添加された製品のラベルには、総糖質の下にAdded Sugar をグラムで記載しなければなりません。添加糖類が1グラム未満の製品のラベルには甘味料や砂糖のクレームをしていない場合には、添加糖分の値を記載する必要はありません。この場合はラベルに栄養分析表の下に「重要な糖源がありません "Not a significant source of added sugars"」と表示する必要があります。
規則では「添加された糖分」を「食品加工中に添加された糖、またはパッケージされた糖分」と定義されており、食品に添加される意図でパッケージに含まれている糖分を意味しています。添加された糖分の定義には、シロップおよびハチミツ由来の糖ならびにフルーツや野菜のジュースに通常含まれる量を超える濃縮ジュースからの糖分も含まれます。特定の蜂蜜、メープルシロップ、およびクランベリー製品のラベルは、これらの糖分が天然に存在しているものか、または嗜好性を改善するために使用されたものか"†"マークを使って説明することが許可されています。
食品製造会社は、加工前及び加工中に添加された糖類、並びに食品と一緒にパッケージされた糖類を記録し保存することを要求しています。砂糖が発酵またはカラメル化によって減量された場合、記載された量が正しいことを確認する科学的データの記録を保持するか、代替策として遵守手段を申請することができます。このように製造会社はすべてのデータの正確性について正当化する必要があります。また、FDAは、製造会社に対し製品が米国市場に導入されてから2年間は記録を保管することを義務付けています。
<背景>
1990年に提案された栄養分析表の規則には、全ての糖分よりも添加された糖分についての記載がより必要であるとの意見もありましたが、両方を必要と提案したコメントもありました。当時、FDAは、そのような要求は必要ではなく、ほとんどの食品において添加された糖と天然に存在する糖とを区別することも実現可能ではないと判断しました。しかし、2015年のDietary Guidelines Advisory Committee
(DGAC) 食品ガイドライン諮問委員会の報告書は、低糖摂取と心血管疾患のリスクの低下との強い相関関係に基づき、アメリカの食事中の砂糖を減らすことを推奨しています。DGACの報告書は、FDAの以前の決定の再考に寄与し、2016年の最終規則で追加された糖の記載を義務付ける事になりました。
出所:FDA website
https://www.fda.gov/Food/GuidanceRegulation/GuidanceDocumentsRegulatoryInformation/LabelingNutrition/ucm385663.htm
2018年1月31日
FDAは、認定第三者認証プログラムの下で認定機関第一号を認定、またVQIP自主認定輸入者プログラムを開始
FDAは、FDA食品安全近代化法(FSMA)によって作成された第三者認証プログラムの下で、認定機関の第一号を認定したと発表。認定機関はANSI-ASQ National Accreditation
Board(ANAB)であり、この機関はウィスコンシン州ミルウォーキーに拠点を置く米国規格協会(ANSI)と米国品質協会(ASQ)が共同で所有する組織。この組織は、FDAの要求基準を満たしており認定機関として適切であるとされたもの。FDAはANABを5年間の期限で認定している。認定に関するFDAの基準の詳細については、下記の「認定された第三者認証プログラムのキーファクト」のリンクを参照の事。
Key Facts about the Accredited Third-Party Certification
Program
更に、米国食品医薬品局(FDA)は、人および動物向け食品の迅速な審査と米国入国を促す自主的な手数料ベースのプログラムであるVQIP(Voluntary Qualified Importer Program)を開始した。VQIPに参加することに関心を持つ輸入者は、外国の供給会社の施設が第三者認証プログラムの下で認定されていることを確実にする事など含む資格要件を満たすことが求められている。
VQIP適格性を確立するために使用されることに加えて、FDAは輸入製品またはそれを生産する施設が米国に入る前に認定されることを特定の状況において要求することもできる。これらのプログラムは、FDAが米国に輸入された食品が国内で生産された食品と同じ安全基準に従って製造されることを確実にするのに役立つツールです。FDAに認定された“認定機関”になることに関心のある政府、機関、または組織は、FDAのWebベースの申請書を使用して申請することができる。
VQIPに興味の有る輸入業者は以下のリンクで詳細を御確認ください。
Voluntary Qualified Importer Program (VQIP)
Outlining the Benefits of the Voluntary Qualified Importer ProgramFSMA Final Rule on Accredited Third-Party Certification
2018年1月4日
2017年度のFDAによる食品施設検査の結果
FDAによる2017年度(2016年10月1日から2017年9月30日まで)の検査結果は以下の通り。
| 規制番号 | 内容 | 説明 | 頻度 |
|---|---|---|---|
| 21 CFR 110.35(c) |
効果的な有害生物排除の欠如 | 加工区域から害虫を除外する、または害虫による敷地内の食品の汚染から保護するための効果的な対策が講じられていない。 | 330 |
| 21 CFR 110.20(b)(7) |
スクリーン(網戸) | 適切なスクリーンがない、または害虫に対するその他の対応策が提供できていない。 | 211 |
| 21 CFR 123.11(b) |
衛生監視 | 最新の適正製造基準への適合を保証するのに十分な頻度で衛生条件および慣例を監視していない。例えば氷を製造するために使用される水を含む、食品または食品に接触する水の安全性や食品に接触する機材の清潔さ、手洗い、手の消毒、トイレ設備の維持、食品包装材の汚染混入防止。毒性のある化学物質の適切な表示、保管や使用、従業員の健康状態の管理、害虫の排除等。 | 203 |
| 21 CFR 110.20(b)(4) |
床、壁、天井 | 工場は床、壁、天井が適切に清掃され、きれいに保たれるように構築されていない。 | 192 |
| 21 CFR 110.35(a) |
施設/衛生 | 建物、備品、その他の物理的設備が衛生的な状態に維持できていない。 | 176 |
| 21 CFR 123.6(b) |
HACCP計画の導入 | HACCP計画にリストされているモニタリング、記録管理、検証の手続きが導入されていない。 | 162 |
| 21 CFR 110.35(a) |
洗浄および消毒作業 | 食品、食品接触面、食品包装材を汚染から保護するための器具および機器の清掃および衛生管理が行なわれていない。 | 157 |
| 21 CFR 110.80(b)(2) |
製造条件 | 微生物の増殖の可能性やコンタミネーションを最小限にするために必要な条件と管理下で、食品を製造、パッケージング、保管することができていない。 | 156 |
| 21 CFR 110.80 |
合理的な予防措置 | 生産の手順がいかなる汚染源からの汚染の原因にならない事を確実にするために、すべての妥当な予防策がとられているとは言えない。 | 146 |
| 21 CFR 110.20(a)(1) |
ハーバレッジ・エリア | 建物または構造物のすぐ近くに有害生物の誘引物質、繁殖場所、または巣となるような可能性のある状態を取り除くための適切な装置の保管、ゴミや老廃物の除去、雑草や芝草の刈り込みが出来ていない。 | 137 |
詳細は以下のリンクをご参照。
https://www.fda.gov/ICECI/Inspections/ucm589892.htm#Foods
2017年12月11日
「食品施設検査の拒否」について
 FDA食品安全近代化法(FSMA)は、米国食品医薬品局(FDA)に、食品を生産している外国の施設がFDAの検査を承諾しない場合、そこで製造された食品を米国に輸入する事を拒否する権利を与えている。それに関しFDAの視点で、どのような食品施設や政府の行動が「検査の拒否」に該当するかについてガイダンスの草案を発行した。米国で販売されている食品は世界中から輸入されていおり、食品施設の検査は、食品供給の安全性を確保するためにFDAが使用する重要なツールの一つである。
FDAは、食品が米国に到着する前に潜在的な食品安全性の懸念を特定するために外国の食品施設の検査を行っているが、FDAが施設に入り検査することに承諾しない場合がある。FSMAの下で、FDAはそのような施設からの食品の米国への輸入を拒否する権限を有している。このガイダンス案の中でFDA、すべての「検査への拒否」が直接的な陳述ではないことを認識している。「拒否」は、検査を遅らせようとしたり、避けようとしたり、FDAの検査官を誤認させたりするために外国企業が採用する受動的または欺瞞的な戦術であると定義している。このガイドライン案は、FDAが検査を実施する際に遭遇する可能性がある状況を例示するために作成された。
FDA食品安全近代化法(FSMA)は、米国食品医薬品局(FDA)に、食品を生産している外国の施設がFDAの検査を承諾しない場合、そこで製造された食品を米国に輸入する事を拒否する権利を与えている。それに関しFDAの視点で、どのような食品施設や政府の行動が「検査の拒否」に該当するかについてガイダンスの草案を発行した。米国で販売されている食品は世界中から輸入されていおり、食品施設の検査は、食品供給の安全性を確保するためにFDAが使用する重要なツールの一つである。
FDAは、食品が米国に到着する前に潜在的な食品安全性の懸念を特定するために外国の食品施設の検査を行っているが、FDAが施設に入り検査することに承諾しない場合がある。FSMAの下で、FDAはそのような施設からの食品の米国への輸入を拒否する権限を有している。このガイダンス案の中でFDA、すべての「検査への拒否」が直接的な陳述ではないことを認識している。「拒否」は、検査を遅らせようとしたり、避けようとしたり、FDAの検査官を誤認させたりするために外国企業が採用する受動的または欺瞞的な戦術であると定義している。このガイドライン案は、FDAが検査を実施する際に遭遇する可能性がある状況を例示するために作成された。
詳細は以下のリンクの通り。
Draft Guidance for Industry: Refusal of Inspection by a Foreign Food Establishment or Foreign Government
2017年11月6日
2015年度の農薬残留レベル分析結果
 FDAによる2015年度の調査結果報告書によると、米国産食品の98%、輸入食品の90%が連邦農薬残留制限に準拠している事が分かりました。農薬は、ヒトおよび動物の食用作物の作物収量に影響を与える可能性がある害虫と戦うため使用されますが、農薬の化学的残留物が一部食品に残ることがあります。FDAは、食品の農薬残留物が、米国環境保護庁(EPA)が設定する連邦安全基準に基づいて制定された限度の遵守を確実にする役割を担っています。
FDAによる2015年度の調査結果報告書によると、米国産食品の98%、輸入食品の90%が連邦農薬残留制限に準拠している事が分かりました。農薬は、ヒトおよび動物の食用作物の作物収量に影響を与える可能性がある害虫と戦うため使用されますが、農薬の化学的残留物が一部食品に残ることがあります。FDAは、食品の農薬残留物が、米国環境保護庁(EPA)が設定する連邦安全基準に基づいて制定された限度の遵守を確実にする役割を担っています。
2015年度(2014年10月1日から2015年9月30日まで)のサンプリング調査によると、食品の農薬残留物のレベルは、一般的にはEPAによって確立された限度を大きく下回っているとFDAは報告しています。更に、国内食品の49.8%、輸入食品の56.8%には農薬残留物が全く検出されなかったとしています。当局は、国内サンプルの2%未満(835のうち15)および輸入食品サンプルの10%未満(4737のうち444)においてのみ、制限以上の残留レベル、または制限が確立されていない農薬の残基があったとしています。
FDAは動物飼料も調査しており、米国産飼料の215の51.6%、輸入飼料の202の57.9%に農薬残留物は全く検出されませんでした。飼料のサンプル中3%未満(12サンプル)に、殺虫剤等の制限を上回る化学物質残留物が含まれていたことが判明しました。
2015年度には規制モニタリングプログラムで5,989サンプルを分析しました。内訳はヒト消費用の食品5,572、動物飼料417、輸入サンプルの違反率は一般に国内サンプルよりも高いため、FDAは輸入品4,737品目に対し、国内品目835品目とより多くの輸入商品を検査しました。これは、国内39州、DC、および111カ国からの輸入食品サンプルを含んでいます。
FDAは、農薬残留物に対するEPAの設定した制限遵守を強化するために3重の戦略を適用しています。規制農薬残留モニタリングプログラムでは、FDAは幅広い輸入品および国内商品を選択的にサンプリングし監視しています。FDAはまた、関心のある商品群について重点的にサンプリング調査も実施しています。更にFDAは、米国の平均的な食事中の汚染物質および栄養素を監視するプログラムであるTotal Diet
Study(TDS)で消費準備された食品中の農薬残留物のレベルを監視してます。このようにFDAは、農薬残留物について、EPAおよび米国農務省と責任を共有し、その責任を非常に真摯に受け止めています。この報告書によるとFDAによって測定された農薬残留物のレベルは総体的に見てEPAの許容値以下に保たれているという事が示されています。
2017年10月30日
大豆タンパク質が心臓病のリスクを低減させるという健康強調表示を取り消す提案
食品や栄養素の中には特定の疾患や状態のリスクを低減するのに役立つものがあることは、長い間認識されてきており、1990年以来、FDAは、食品のパッケージに記載されている健康強調表示が確固たる科学的実証に基づくために、食品の健康強調表示を評価する責任を担っています。FDAは現在までに、骨粗鬆症のリスクを軽減するのに役立つカルシウムやビタミンDの効果や、癌のリスクを低下させるの効果がある特定の果物や野菜など12件の健康強調表示を承認しています。
FDA認可の健康強調表示は、最も堅牢な科学的証拠に基づいて確立された事実を反映していることを要しますが、昨今、FDAは大豆タンパク質と心臓病に関する健康強調表示を取り消す事を提案しました。1997年にこの強調表示が承認されて以来、多くの研究が行われてきましたが、大豆タンパク質と心臓病の関係について一貫性のない知見が示されてきたため、初めて健康強調表示を取り消す提案をする必要があるとしたものです。徹底的なFDAによるレビューを受けた結果この提案に至っており、消費者が信頼できる情報に基づいて食物の選択をする事ができるようにというFDAのコミットメントの強さが伺われます。
 大豆タンパク質と心臓病のリスクの低減との関係を示唆する証拠も存在してはいるものの(FDAが健康強調表示を認可した時点でFDAが審査した証拠を含む)、現在利用可能な科学的証拠を総体的に見た場合、この関係の確実性に疑問を投げかけています。例えば、FDAが健康強調表示を承認した後に発表されたいくつかの研究では、低密度リポタンパク質(LDL)コレステロールを低下させるという事については一貫性のない知見が示されています。その証拠を検討した結果、大豆タンパク質と心臓病との関係に関するデータは、FDA認可の健康強調表示の厳しい基準を満たしていないと結論づけています。
大豆タンパク質と心臓病のリスクの低減との関係を示唆する証拠も存在してはいるものの(FDAが健康強調表示を認可した時点でFDAが審査した証拠を含む)、現在利用可能な科学的証拠を総体的に見た場合、この関係の確実性に疑問を投げかけています。例えば、FDAが健康強調表示を承認した後に発表されたいくつかの研究では、低密度リポタンパク質(LDL)コレステロールを低下させるという事については一貫性のない知見が示されています。その証拠を検討した結果、大豆タンパク質と心臓病との関係に関するデータは、FDA認可の健康強調表示の厳しい基準を満たしていないと結論づけています。
但し、大豆タンパク質を食べることと心臓病のリスクを低下させることとの関連を裏付ける十分な証拠がある限り、FDAはQualified Health Claims(認定健康栄養)としての表示を許可する方向で検討しています。認定健康表示はAuthorized Health
Claims(承認された健康強調表示)よりも低いレベルの科学的基準の証拠を要する表示文言であり、大豆タンパク質の消費と心臓病リスクの減少を結びつける限られた証拠を説明する適格な言語を業界が使用できるようにするものとみられています。
FDAは、このトピックに関心を持つ関係者と協力するために、提案したルールに関するコメントを受けつけています。コメント期間は75日間であり、最終的なルール作成を続行するかどうかが決定されます。製造業者は、FDAが最終決定を下すまで、現在認可されているクレームを製品に引き続き記載しておくことを許可しています。
大豆製品を食べることについて疑問を抱く消費者にとっては、2015-2020年の食事ガイドライン(ダイエットガイドライン)のアドバイスに従うことをお勧めします。このガイドラインでは、健康な食事パターンには大豆飲料や大豆製品を含むさまざまなタンパク質食品が含まれます。 問題となっている健康強調表示は、大豆タンパク質が冠状動脈性心臓病のリスクを低減することに関するもので、
大豆または大豆由来の食品成分(大豆油など)の他の健康に役立つとされる利点については、今回提案された規則の変更には含まれてません。
2017年9月29日
栄養分析表示の新規制適用日の延長を提案
FDAは2016年7月に栄養分析表示の新規制を発表したが、新規制適用日について当初の2018年の7月26日を2020年の1月1日とし、売り上げ1,000万ドル以下の小製造業については2019年7月26日を2021年の1月1日までとそれぞれ一年半延長する事を提案しました。
この提案は新規制適用日の延長のみに係るもので栄養分析表や一食当たりの量など新規制の内容そのものについての変更は含まれていません。企業や業界団体は、最終規則の実施に関する多くの技術的問題等につきFDAからの明確な回答を得、対応するために要する時間について懸念を継続的に表明してきておりこの度FDAが適用期限を延長することによる対応を提案したものです。
2017年7月20日
食品の安全性向上、食品を媒介とする疾患を軽減するためにFDAは3000万ドルを授与
 FDAのコミッショナー、スコット・ゴットリーブ医師は、食品を媒介とする疾患を予防する食品安全性のシステムの構築を目指し今後数年に亘る教育、アウトリーチ、技術的援助に要する資金として43州に対し3,090万ドルを授与する決定を発表しました。
FDAのコミッショナー、スコット・ゴットリーブ医師は、食品を媒介とする疾患を予防する食品安全性のシステムの構築を目指し今後数年に亘る教育、アウトリーチ、技術的援助に要する資金として43州に対し3,090万ドルを授与する決定を発表しました。
食品安全近代化法(FSMA)の導入を支援するために州に提供される資金は、様々な農業活動を強調し各州特有のニーズに答えるプログラムを促進するために使われます。同氏は、「FSMAは、食品安全システムを、汚染が起こってから対応する食品安全システムから、防止するものへと変えるものである。この変化は、食糧生産者や栽培者が新しい要件を理解し達成するためFDAに協力してくれる各州のパートナーの支援なしには起こり得ない。」とコメントしています。
更に、同氏は「現在の食糧供給安全性のシステムの下では、食物媒介による疾患により毎年約3,000人ものアメリカ人が死亡する他、多数の入院患者をもたらしている。FSMAは、人間が消費する果物や野菜の安全な栽培、収穫、梱包、保持のために、科学的根拠に基づく最低限の基準が実施されていることを確実にするもの。」としています。
安心して各家族が食生活していける安全な食物の供給は国民皆が望んでいることであり、FDA史上最大規模の資金授与が、FSMAを通じて食品安全の監督に関するリスクベースのアプローチを改革し、強化するのに役立つものとしています。安全を確保するために近代的な標準システムによって生産物が監督されていることを消費者が知る事に因る経済的および公衆衛生上のベネフィットは計り知れないものがあります。
FDAと国家農業省(NASDA)は、2014年に実施基金をどのように使用するかについての共同戦略のため協力協定を締結、NASDAは、生産ルールの遵守を強制するためのに、「モデル生産安全実施枠組み」と「農場での準備状況確認プロセス」を開発します。
FSMAの生産安全規則は、農産物と接触する灌漑用水を含む農業用水の微生物品質基準を設定しているが生産者側は、収穫前の微生物の水質に関する数値基準を含む水基準は、理解し、実施するためには複雑すぎるのが問題としています。更に、生産者側は、FDAが新しい規則の実施に関連する技術的な質問に答えるのに時間がかかり過ぎている事も問題であると言っています。また、小規模の農場はFSMAから免除されているものの、農業用水の試験と基準に関する規定は問題として残っています。農業用水は農産物を汚染する病原体の主要な導管であるため、コンプライアンスの向上を目指して公衆衛生を保護しながらも農業用水の微生物の試験要件を簡素化する方法を検討中です。
2017年5月
FSVP(外国供給者検証プログラム)施行
 多くの米国輸入者は、2017年5月30日を期限に米国食品医薬品局(FDA)の外国供給者検証プログラム(FSVP)規則を遵守してしておく必要があります。FDAのFSVP規則は、FSMAに基づき2015年11月に最終決定されたもので、FSVP輸入者が輸入食品が米国安全基準を満たす方法で製造されていることを確認することを義務付けるものです。
多くの米国輸入者は、2017年5月30日を期限に米国食品医薬品局(FDA)の外国供給者検証プログラム(FSVP)規則を遵守してしておく必要があります。FDAのFSVP規則は、FSMAに基づき2015年11月に最終決定されたもので、FSVP輸入者が輸入食品が米国安全基準を満たす方法で製造されていることを確認することを義務付けるものです。
サプライヤー(仕入先)の評価と承認
FDAのFSVP規則では、FSVP輸入者は原則として承認された外国のサプライヤーからのみ輸入することを義務づけています。サプライヤーの承認のためにFSVP輸入者は、サプライヤーはFDAの食品安全規則の遵守状況を考慮する必要があります。これはFDAの警告書(warning letter)や輸入警告(import alert)の対象であるかどうかの確認や、その他の食品安全に関するFDAの遵守状況を確認する事などが含まれます。
リスクベースのFSVP
FSVPは、適切な教育、訓練、そして経験を有する適切な人材によって作成、実行されるべきものです。例えば、実施においてはレビューに必要とされる記録文書等の言語を読解する能力を有する「適格者」が行わなければなりません。
FSVPには、ハザード(危険・有害)分析と適切なサプライヤー検証活動が含まれ、これによりハザードが大幅に最小化または防止されることを確実にするものであるべきです。また、サプライヤーの検証活動の例には、監査、記録レビュー、サンプリングとテストが含まれます。
それぞれのサプライヤーの適切な検証活動は、輸入される食品の種類とサプライヤーのコンプライアンス履歴によります。
是正措置
FSVP輸入者が承認されてるサプライヤーが不適合となった場合、輸入者は是正措置が取られるように対応する必要があります。例えば、外国のサプライヤーがインポートアラートに載ってしまった場合には、適切に是正措置をとる事が必要です。ラベルの記載方法・内容の不適切により拘留措置が取られるケースも多いので、出荷前に適切な対応をしておく事は輸入通関の際の問題防止として有効です。
2017年2月28日
食品色素としての野菜や果物のジュースについて
FDAは食品に色素として添加される野菜や果物のジュースについての業界向けドラフトガイダンス(draft guidance for industry: fruit juice and vegetable juice as color additives in food)についてのパブリックコメント募集を再開しました。具体的には3月1日から60日間の間関係各位からのコメントを募集しており、コメントをしたい方は以下のリンクから入ることができます。
Federal Register Notice Announcing Reopening of
the Comment Period
このガイダンスの最終版が発行されると食品に色素として野菜や果物のジュースを添加する場合、どのようなものがFDAの承認等を必要としないものかが明確に示されることになります。FDAは一般に色素に関しては厳しく規制に則って取り締まっており野菜や果物のジュースによる色素は種類や使用用途などが21 CFR 73.250と21 CFR
73.260の連邦規則で定められています。 まず、野菜や果物のジュースの基となる野菜や果物が食品として安全に消費されているものである必要があります。例えば、紫トウモロコシや黒ニンジンからのジュースを色素として使用する事は規制に沿った使用方法である限り問題無くとも、サフラワーの花びらやハイビスカスの花は規制に沿っているとは言い切れません。このような場合は食品会社は安全性のデータを纏めてFDAに安全性についてのレビューを申請しなければなりません。野菜や果物のジュースであっても色素として使われる場合、何であるかをラベルに記載する事が要求され"Artificial
Color"、"Artificial Color Added"、 or "Color Added"、"Colored with Fruit Juice"、"Vegetable Juice Color"などと明記する必要があります。
2017年1月18日
FDAとEPAによる魚の摂取量アドバイス
 FDAとEPAは魚貝類の摂取量についてのアドバイス(advice regarding fish consumption)を公表しました。
内容は妊娠中、妊娠予定の女性、授乳中、小さな子供の親が魚貝類を食する場合の健康的な選択を容易にすることを意図しています。どの魚介類を選択しどのくらいの量を摂取するのが適切かを62種類の魚介類について3つのカテゴリー分けし表で示す事により分かり易く紹介しています。また、FDAは米国で消費される魚介類の約90%がベストチョイスに含まれる魚介類としています。
FDAとEPAは魚貝類の摂取量についてのアドバイス(advice regarding fish consumption)を公表しました。
内容は妊娠中、妊娠予定の女性、授乳中、小さな子供の親が魚貝類を食する場合の健康的な選択を容易にすることを意図しています。どの魚介類を選択しどのくらいの量を摂取するのが適切かを62種類の魚介類について3つのカテゴリー分けし表で示す事により分かり易く紹介しています。また、FDAは米国で消費される魚介類の約90%がベストチョイスに含まれる魚介類としています。
-- "ベストチョイス" (週に2~3回)
-- "グッドチョイス" (週に1回)
-- "避けたい魚介類"
FDAの調査によると妊娠中の女性の半数は一週間の魚介類の消費量は2オンス(57g)以下と推奨消費量を大きく下回っているが、魚介類には胎児や幼児の発育に重要な栄養素が含まれるため消費者が最低量は魚介類を消費する事とアドバイスしています。
同アドバイスではマーキュリー含有量の少ない魚介類を週に2回から3回、合計で8~12オンス(227g~340g)の消費を勧めています。しかし、魚介類はどの種類でも少量でもマーキュリーを含んでいるため長期に亘って大量に摂取し過ぎると脳や神経のシステムへの悪影響が及ぼす可能性があるため一週間の上限は12オンス(340g)としておりこの基準は "2015 - 2020 Dietary Guidelines for Americans"
の内容とも一致しています。大人の魚介類の消費量は一食分は4オンス(104g)程度、子供の一食分の量はそれより少量であり年齢や一日摂取カロリーに応じて調整する必要があるが、週に1回から2回多様な魚介類を食する事をアドバイスしています。
詳細は以下のリンクをご参照
Eating Fish: What Pregnant Women and Parents Should Know (FDA/EPA's advice regarding fish consumption)
2017年1月13日
RTE食品のリステリアの対応策について業界ガイダンスを改定
 FDAはRTE食品( Ready-To-Eat Foods=すぐに食べられる食べ物)のリステリア抑制対策についてドラフトガイダンスの改定を行いました。(draft guidance, "Control of Listeria monocytogenes in Ready-To-Eat
Foods")。RTE食品の増加傾向のもと特にチーズなど乳製品でリステリアが検出されるケースも多く発生していることが背景にあります。リステリアは冷蔵温度の環境下でも増加する有害細菌で特に抵抗力の弱まった高齢者、妊婦、がん患者への潜在的リスクは大きく政府や関連当局はリステリアのリスクの低減を目指しています。このドラフトはFDAの食品安全強化法と一貫した動きで(FDA Food Safety Modernization Act
(FSMA))、FDAのGMPの要求事項、予防・抑制策の検証を含むHARPC(hazard analysis and risk-based preventive controls)と同様の考え方に基づいています。
FDAはRTE食品( Ready-To-Eat Foods=すぐに食べられる食べ物)のリステリア抑制対策についてドラフトガイダンスの改定を行いました。(draft guidance, "Control of Listeria monocytogenes in Ready-To-Eat
Foods")。RTE食品の増加傾向のもと特にチーズなど乳製品でリステリアが検出されるケースも多く発生していることが背景にあります。リステリアは冷蔵温度の環境下でも増加する有害細菌で特に抵抗力の弱まった高齢者、妊婦、がん患者への潜在的リスクは大きく政府や関連当局はリステリアのリスクの低減を目指しています。このドラフトはFDAの食品安全強化法と一貫した動きで(FDA Food Safety Modernization Act
(FSMA))、FDAのGMPの要求事項、予防・抑制策の検証を含むHARPC(hazard analysis and risk-based preventive controls)と同様の考え方に基づいています。
これによりRTE食品を製造、プロセス、パックそして保存する施設にとってリステリアによるリスクの抑制の明確なガイダンスが設けられることになりました。USDAのFood Safety and Inspection Service (FSIS)
とFDAが統合したアプローチでガイダンス公表をするためRTE食品を扱う施設はリステリアのリスクに関して統一した明確な基準に沿って操業する事ができるようになります。同ガイダンスには、人員の管理、設備の清掃とメンテナンス、衛生上の管理、および生産と消費の間のリステリア殺菌処理や食品を保管する際のリステリアの増加を抑える方法などの処理に関する勧告が含まれています。改定されたドラフトガイダンスは、RTE食品を変更したりするものではありません。
詳細は以下のリンクをご参照
Draft Guidance for Industry: Control of Listeria monocytogenes in Ready-To-Eat Foods
2016年12月29日
"ヘルシー"の定義について
 FDAはヘルシーの定義についてのパブリックコメントの期日を当初設定された2017年1月26日から4月26日まで延長しました。
FDAはヘルシーの定義についてのパブリックコメントの期日を当初設定された2017年1月26日から4月26日まで延長しました。
9月27日にFDAは"healthy"
「健康的な」食品の栄養素含有量の要求事項について再定義するための正式なプロセスを開始したと発表しました。"ヘルシー"というクレームをするための要求事項を再定義することにより、消費者が公衆健康勧告に合致した食品の選択を容易かつ迅速に行うことができ、食品関連業界がより健康的な食品の開発を促進するための情報とツールを提供する事になります。"ヘルシー"という用語をFDAが再定義していく検討中は、食品メーカーは現在の規制定義に適合する食品については引き続き"ヘルシー"というクレームを使用できるとしています。
"2015-2020年アメリカ人の食事ガイドライン"や栄養成分分析表のラベル改定にも反映されるように、栄養素の健康への勧告は変化・発展してきています。例えば、健康的な食事パターンとして現在、食品群に焦点を当てており、消費される脂肪の総量よりも脂肪のタイプ、そして加えられた糖分の量も注目されるようになりました。また、消費者が十分に摂取していないと懸念される栄養素も変わりました。
FDAは、このような背景のもと"ヘルシー"という言葉を再定義するために、公共の意見や情報を求めています。
追加情報のリンク:
- "Healthy" on Food Labeling
- Constituent Update: FDA to Redefine "Healthy" Claim for Food Labeling
- Guidance for Industry: Use of the Term "Healthy" in the Labeling of Human Food Products
- Federal Register Notice for the Guidance for Industry
- Federal Register Notice for the Request for Information
2016年12月21日
FDAによるFSMAトレーニング計画
 FDAは食品安全化近代化法(FSMA)の導入の成功には、食品業界へのトレーニングが重要という認識のもと、FSMA規則の要件を満たすための必要な準備について国内外の食品製造者および輸入業者を訓練するための計画を掲示しています。
2016年5月に、FSMAを導入する基本ルールは基本的に全て最終的なものとされFDAは、過去1年間に行われた進捗状況を反映するための最新のトレーニング計画を発表しています。
FDAは食品安全化近代化法(FSMA)の導入の成功には、食品業界へのトレーニングが重要という認識のもと、FSMA規則の要件を満たすための必要な準備について国内外の食品製造者および輸入業者を訓練するための計画を掲示しています。
2016年5月に、FSMAを導入する基本ルールは基本的に全て最終的なものとされFDAは、過去1年間に行われた進捗状況を反映するための最新のトレーニング計画を発表しています。
- 持続可能な有機農法に従事する農業を含む地方の食糧生産に関わる中小企業に焦点を当てた協調協定が、全国農業組合財団に授与されました。
- ネイティブ・アメリカン部族の食糧生産者の準備に焦点を当てた協調協定が、アーカンソー大学に授与されました。
- 米国農務省国立農業研究所(NIFA)とFDAの提携により、トレーニングの提供を促進するための地域センターの設立に関して、以下の大学に連邦政府グラントが授与された。
- 南部地域センター:フロリダ大学
- 西部地域センター:オレゴン州立大学
- 北中央地域センター:アイオワ州立大学
- 北東地域センター:バーモント大学と州立農業大学
このプログラムは、農家、小規模食品会社、小規模農産物卸売業者に焦点を当てているものです。
追加情報のリンク:
FDA’s Strategy for FSMA Training: Public and Private Partners Working Together
2016年12月19日
チェーン・レストランメニューの栄養情報開示コンプライアンス適用日
 米国食品医薬品局(FDA)は、2014年に公表した特定のチェーンレストランなどのメニューのラベリング規制の遵守日を当初予定の2016年12月1日から2017年5月5日に延長する最終規則を正式発表しました。本規制はチェーンレストランの標準的なメニューに特定の栄養情報を開示することを義務付けるもので
、2016年5月5日にFDAは最終ガイドラインを発表しました。FDAはその際2017年5月5日より前にメニューラベリング要件の実施を開始しないことは明確にしていたが、コンプライアンス適用日については今回正式に発表されたものです。
米国食品医薬品局(FDA)は、2014年に公表した特定のチェーンレストランなどのメニューのラベリング規制の遵守日を当初予定の2016年12月1日から2017年5月5日に延長する最終規則を正式発表しました。本規制はチェーンレストランの標準的なメニューに特定の栄養情報を開示することを義務付けるもので
、2016年5月5日にFDAは最終ガイドラインを発表しました。FDAはその際2017年5月5日より前にメニューラベリング要件の実施を開始しないことは明確にしていたが、コンプライアンス適用日については今回正式に発表されたものです。
追加情報のリンク:
Menu Labeling Requirements
2016年9月2日
FDAは 抗菌性(Antibacterial)洗浄剤の安全性と有効性に関する最終規則を発表
FDAは、特定の有効成分(トリクロサン及びトリクロカルバンを含む19種類の物質)を原材料とする消費者向け抗菌性洗浄剤の販売を禁止する最終規則を公表しました。メーカーがこれら特定の成分の入った製品の長期的な使用に関する安全性と通常の石鹸等よりも病気や感染症のまん延を防止する上でより効果的であるということを実証することができなかったとしています。
この規制の対象となる製品は、石鹸やボディワッシュのように使用後に水で洗い流すもので、消費者用の「抗菌剤」またはワイプ、または医療現場で使用される抗菌用製品には適用されません。
「消費者は抗菌性洗浄剤が病原菌の拡散を防止するのに普通の石鹸よりも効果的と思うかもしれないが、そのような科学的な証拠がない。実際には、長期に亘っての抗菌成分の使用が害を及ぼす可能性があることを示唆するデータもある。」とFDAのCDER (Center of Drug Evaluation and Research =医薬品評価研究センター)のディレクターがコメントしています。
FDAは2013年にトリクロサン(液体石鹸用)およびトリクロカルバン(固形石鹸用)の長期的使用が細菌への抵抗力減退やホルモンへの影響として健康上のリスクをもたらす可能性があることを示唆するデータがあることを受けて規則案を公表しました。規則案では、メーカーが抗菌性洗浄剤の販売の継続を希望するのであれば特定成分の安全性と有効性に関する追加データをFDAに提供する必要があるとしています。追加データは抗菌性の製品が人間の病気の予防、そして感染を減少させるのに非抗菌性洗浄剤よりも優れていることを実証する臨床研究のデータを含むものです。
メーカーは期限までに19の成分の安全性と有効性を確立するために十分なデータをFDAに提供することができませんでしたが、業界の強いリクエストにより塩化ベンザルコニウム、塩化ベンゼトニウム及びクロロキシレノールの3成分については安全性と有効性データの提出のためFDAはもう1年の延期を認めました。これらの成分の含まれている抗菌性洗浄剤についてはデータが収集されている間は販売することができるとしています。
非抗菌性の石鹸と流水による洗浄は、病原菌の拡散を防ぐための最も重要なステップの一つとされています。CDC(Center of Disease
Control=疾病管理予防センター)は、石鹸と流水による洗浄が出来ない場合、消費者は消毒剤を使用しますが、少なくともアルコールが60%含有されている消毒剤を使用することを勧めています。2013年のFDAの規則案発表以来、メーカーはすでにトリクロサン及びトリクロカルバンを含む抗菌性の洗浄剤の使用を段階的に廃止し始めています。今回の発表により、市場から抗菌性成分を含む製品を削除したり、フォーミュレーションを変更することにより規則を遵守していくのに1年間の猶予があります。
追加情報のリンク:
- Vending Machine Final Rule: Food Labeling; Calorie Labeling of Articles of
Food in Vending Machines
- Menu and Vending Machines Labeling Requirements
2016年8月29日
ナトリウム摂取削減に関するガイダンス案へのコメント期間延長
FDAは食品製造業界などに対し自主的にナトリウムを削減するための業界へのガイダンス案に関するコメント期間の延長を発表しました。
- 短期(2年)のナトリウム削減目標に関連するコメント期間は当初予定の2016年8月31日から10月17日に延期。
- 長期(10年)のナトリウム削減目標に関連するコメント期間は当初予定の2016年8月31日から12月2日に延期。
2016年6月1日にFDAは、食品業界のための自主的なナトリウムの削減目標を提供するパブリックコメントのためのガイダンス案を公表しました。ドラフト短期(2年)の目標は、ナトリウム摂取量を1日当たり約3000mgに減少させるように努めており、長期(10年)の目標は、一日当たりの摂取量を2300mgに減らすことを目指しています。このガイダンス案は、約150の食品のカテゴリーを含み、食品中のナトリウムを低減するために食品メーカー、レストラン、フードサービス事業の既存の努力を補完することを意図しています。
アメリカ人は専門家が推奨しているナトリウム摂取量の50パーセント以上も上回るナトリウムを摂取しており、3人に1人は、心臓病や脳卒中の主要な危険因子であるされている高血圧であり、高血圧はナトリウムの高いダイエットとリンクしているとされています。また、ナトリウム摂取の大部分がプロセスされた食品に含まれているものです。
このガイダンス案に関するコメントの期間は6月2日から90日間以内に提出する事になっていましたが今回業界のリクエストを考慮し延長を発表しました。FDAはガイダンスの最終版を作成する前にガイダンス案への各業界からのコメントを十分に考慮していく事を意図するものとみられます。
追加情報のリンク:
- Sodium Reduction At A Glance (includes Questions & Answers)
- Draft Guidance for Industry: Voluntary Sodium Reduction Goals: Target Mean and Upper Bound Concentrations for Sodium in Commercially Processed, Packaged, and Prepared Foods
- Federal Register Notice Announcing the Draft Guidance
- Blog: Reducing Sodium in the Food Supply
2016年7月8日
自動販売機で販売される食品のカロリー表示コンプライアンス適用日一部延長
FDAはガラスフロントの自動販売機で販売されている食品のカロリーの表示要件についてのコンプライアンス適用日を2016年12月1日から2018年7月26日に延長することを近く正式発表する予定です。
自動販売機用の食品のカロリー表示のコンプライアンス適用日につき、複数の業界団体からの延長要求を留意し、パッケージのフロント(FOP)のカロリー開示文字のサイズに関する懸念を理由とするものです。 FDAへのリクエストの中で、複数の業界団体はFOPのカロリー表示のサイズを正味量表示のサイズの150%に変更することを求めています。現在、業界は自主的に正味量表示の100%から150%のサイズでカロリー表示をする必要があるとしていますが
FDAの最終規則ではFOPの最大の文字のサイズの50%以上のサイズであることが必要としています。FDAは業界の懸念を受けて文字のサイズについても更にコメントを聞くとしています。
業界団体は最近発表された新栄養成分表の適用コンプライアンス日が2018年7月26日であるため、自販機用食品のFOPのカロリー表示適用日を同日にすればより整合性があるとしてしており、FDAは食品のラベルの変更が全て同じタイミングで行われる点を留意したものです。
一方、当初の2016年12月1日のコンプライアンス適用日は以下の状況では延長なく適用されます。例えばグラスフロントの自販機で販売される場合パッケージ上でカロリー表示が見えない場合は隣接した場所にカロリー表示をする事、また電子表示が可能な自販機の場合は電子表示をすること等です。
FDAはまた、業界の要求に応じて自動販売機で販売されている特定のガム、ミント、ロールキャンディのためのコンプライアンス適用日も2018年7月26日に延長します。2014年12月1日に公表された本最終規則は、所有者が20以上の自動販売機を運営する業務に従事する者を対象として適用されます。
追加情報のリンク:
- Vending Machine Final Rule: Food Labeling; Calorie Labeling of Articles of
Food in Vending Machines
- Menu and Vending Machines Labeling Requirements
2016年5月20日
新ラベル規制 - 食品栄養分析表
 栄養表示基準は消費者が適切な情報に基づいて食品を選択し健康的な食事の習慣を維持するためにFDAにより20年以上前に導入されました。
2014年3月にFDAはラベルを更新するためのルールを提案し、2015年7月には補足規則案を公表しました。栄養表示基準の規制は米国農務省によって管理されている特定の肉や鶏肉、卵加工品を除く全ての加工食品に適用されるもので以下が新規制の重要な3点とされています。
栄養表示基準は消費者が適切な情報に基づいて食品を選択し健康的な食事の習慣を維持するためにFDAにより20年以上前に導入されました。
2014年3月にFDAはラベルを更新するためのルールを提案し、2015年7月には補足規則案を公表しました。栄養表示基準の規制は米国農務省によって管理されている特定の肉や鶏肉、卵加工品を除く全ての加工食品に適用されるもので以下が新規制の重要な3点とされています。
- カロリー、内容量に何食分入っているか、一食分の量の情報のフォントサイズをもっと大きく、太字にし目立つようにする事。
- ビタミンD、カルシウム、鉄分、ポタシウムについては一日の摂取量の何%に当たるかと同時に実際の量を記載する事。その他のビタミンやミネラルの量については任意に記載する事も可。
- 脚注の説明書きの内容は実質上変化ないが表現方法が若干変更。
新脚注: “The % Daily Value tells you how much a nutrient in a serving of food contributes to a daily diet. 2,000 calories a day is used for general nutrition advice.”
新規制の特徴は最新の栄養科学に関する情報を反映していることで具体的には以下の内容が挙げられます。
- 製造工程で加えた糖についてはグラム数と一日摂取量の何%に当たるかをラベルに含める事。
栄養科学上、一日摂取のカロリー制限内で添加砂糖から総カロリーの10%以上を摂取すると、必要な栄養のニーズを満たすことが困難であることを根拠としたもの。これは“アメリカ人のための2015年から2020年食生活指針”と一致している。 - カルシウムと鉄の含有量表示に加え、ビタミンD、ポタシウムの表示を加える事。一方ビタミンAとCの表示は不要ですが自主的に含めることは可能。
- 栄養科学では、脂肪の種類が量よりも重要であることを示しているため、「全脂肪」、「飽和脂肪」と「トランス脂肪酸」の表示は引き続き必要とされるが「脂肪からのカロリー」表示は削除。
- ナトリウム、食物繊維やビタミンDなどの栄養素の一日の摂取量値は、最新の栄養学研究に基づいて更新されている。
一食分の量についてはもっと現実的な水準に変更しました。
- 法律により、一食分の量とは一回に食べるまたは飲むべき量ではなく、実際に食べるまたは飲む量に基づいている必要があります。一食分の消費量が前回決められたのは20年以上前の1993年でアイスクリームの一食分は½カップと定められていました、今回の変更で2/3カップに変更、同様にソーダの一食分の基準量は、8オンスから12オンスに変更されました。
- パッケージサイズは、人々が消費する量に影響するので、例えば20オンスのソーダや15オンス入りのスープは一食分と二食分の間の分量です。このようなパッケージのカロリーや他の栄養素の表示は、人々が通常一回で一パッケージを消費するため一食分を一パッケージ分としてラベル表示することが要求されます。
- パッケージに含まれる容量が一食分よりも大きいが、それが一食分、または複数回に亘って消費することができるような製品については、メーカーはカロリーや栄養素の量を示すために「二重列」のラベルを提供する必要があります。例として、ソーダの24オンスボトルやアイスクリームのパイントでは「二重列」記載を行います。これにより消費者が一回でパッケージを消費する場合と複数回に亘って消費する場合の摂取カロリーや栄養素を容易に把握することができます。
コンプライアンス適用日は約2年後です。
製造会社は製品のラベルを2018年7月26日までに新規制のものに切り替えておく必要があります。売り上げ$10百万以下の会社の適用日は約3年後の2019年7月26日となっています。 |
 |
| 改定前 | 改定後 |
|---|
http://www.fda.gov/Food/GuidanceRegulation/GuidanceDocumentsRegulatoryInformation/LabelingNutrition/ucm385663.htm#highlights
2016年5月4日
米国とカナダが食品安全システムの同等性で合意
 米食品医薬品局(FDA)は、カナダ食品検査庁(CFIA)とカナダ保健省と、お互いの食品安全システムが同様であると認識したという内容の合意をしました。
米食品医薬品局(FDA)は、カナダ食品検査庁(CFIA)とカナダ保健省と、お互いの食品安全システムが同様であると認識したという内容の合意をしました。
FDAは2012年に同様のシステム認識プロセスをニュージーランドと行い合意済みで、今回のカナダとの合意が2カ国目となります。更に現在オーストラリア、ECと同様のプロセスの相互確認を進行中です。
食品安全システムを認識することによって、FDA、CFIA、およびカナダ保健省は、お互い国の科学に基づく規制制度を活用できる他、検査活動に優先順位を付けるときやアウトブレイクがあった際の対応の仕方など様々な分野において規制上協力の枠組みを確立することを可能とします。
2016年4月18日
輸入警告 # 16-136
 FDAは、マレーシア半島からの輸入エビの約3分の1に、ニトロフランおよびクロラムフェニコールの残留があったという検査結果を受け、マレーシア半島からのエビの輸入品を物的検査なしで拘留することができることを発表しました。
FDAは、マレーシア半島からの輸入エビの約3分の1に、ニトロフランおよびクロラムフェニコールの残留があったという検査結果を受け、マレーシア半島からのエビの輸入品を物的検査なしで拘留することができることを発表しました。
2015年にFDAにより行われた検査によると米国で許可されていないニトロフランおよびクロラムフェニコールの抗生物質残留を含むマレーシア半島からのエビの出荷が増加傾向にあることが懸念されています。
ニトロフランおよびクロラムフェニコールを含むエビの米国への輸入は以前から禁止されていますが、今後は物的検査なくマレーシア半島からのエビ輸入ということで拘留されることになります。このためマレーシア半島からのエビの輸入業者は民間のラボラトリーで検査をしエビがこれら抗生物質に汚染されていない証拠を提出する必要があります。FDAは、マレーシア政府に対して問題の原因を調査し、短期および長期のアクションプログラムを策定するようを要求しています。
2014年データでは米国で消費される90%以上の水産物が140ヵ国から輸入され、水産養殖による水産物輸入も増加しており、中でもマレーシア半島はエビ輸入先のトップ10に入っています。 (出所:NOAA National Marine Fisheries
Service) 水産養殖が増加すると同時に米国で許可されていない化学物質や抗菌剤が使用され、米国へ輸入される懸念も増えてきています。FDAではニトロフランおよびクロラムフェニコールの長期に亘る暴露は発がん性など有害であるという科学的事象があるとしています。
2016年1月22日
FDA-チーズ製造会社と刑事・民事訴訟を解決
 デラウェア州のチーズ製造会社ルース フーズ(Roos
Foods)株式会社は、人体に有害な食品を製造販売し、連邦食品医薬品化粧品法(FD&C法)に違反をしたと有罪を認めました。判決によると、もし同社または同社の経営者が、将来食品を製造し販売する事業を再開する場合はFDAにより同社がFD&C法および食品安全に関し適用される全ての規制に準拠していることを確認することができた場合のみとなります。
デラウェア州のチーズ製造会社ルース フーズ(Roos
Foods)株式会社は、人体に有害な食品を製造販売し、連邦食品医薬品化粧品法(FD&C法)に違反をしたと有罪を認めました。判決によると、もし同社または同社の経営者が、将来食品を製造し販売する事業を再開する場合はFDAにより同社がFD&C法および食品安全に関し適用される全ての規制に準拠していることを確認することができた場合のみとなります。
ルース フーズはデラウェア、メリーランド、ニュージャージー、ニューヨーク、バージニアやワシントンDCでチーズを流通・販売していましたが2013年にリステリア菌による食中毒問題で8人の消費者が入院という事件の原因となりました。FDAは食品施設としての衛生上の問題と有害細菌が施設の中で発見されたことを理由に2013年3月11日に食品施設登録を停止させ、製品の製造と流通を全面停止させました。また、この取り調べはFDAのみならず関連する各州の衛生局も巻き込んだ大掛かりな調査となりました。
「FDAは、安全な食品を製造するための適切な保護手段をとることがでず、汚染された製品を出荷し公衆衛生を危険にさらす食品会社を容認することはできません。公共の健康と安全性より利益を最優先する会社に対しては、司法省と協力し司法制度を最大限に活用し対抗していきます。」とFDAグローバル レギュラトリー
オペレーションの副長官スクランバーグ氏は発言。また司法省の民事部門のヘッドであるベンジャミンC.マイザー氏は「食品が危険な細菌を含まない安全なものであることを確保して行かなければならない。粗悪食品の流通につながる行為を阻止するために積極的に取り組んでいきます。」とコメントしています。
2016年1月6日
クラトム(kratom)を含むサプリメンとの差し押さえ
 USマーシャルはFDAの要請でクラトムを原材料とする90,000個のサプリメントを差し押さえました。イリノイ州サウスベロイトのドードニズ ナチュラル プロダクト社の製品で総額40万ドル相当になります。FDAは、クラトムという植物は公衆の安全を脅かす可能性があり乱用の可能性もあるため、法に則りこのサプリメントの原材料からアメリカ国民の安全を守っていくとコメントしています。クラトムはMitragyna speciosa
の俗称で東南アジア諸国、特にタイ、マレーシア、インドネシア、パプアニューギニア産の薬草とされているが、クラトムは呼吸機能の降下、吐き気、減量、便秘などを引き起こし、麻薬および覚せい剤のような効果を有し、離脱症状には敵意、攻撃性、過度の流涙、筋肉や骨のギクシャクした動きや四肢運動の痛みなどを引き起こすとされています。2014年にFDAは輸入警告としてサプリメントやサプリメントの材料としてクラトムを拘留していくことを発表し、2016年1月にはレラクスプロ(RelaKzpro)の拘留を実施しました。
USマーシャルはFDAの要請でクラトムを原材料とする90,000個のサプリメントを差し押さえました。イリノイ州サウスベロイトのドードニズ ナチュラル プロダクト社の製品で総額40万ドル相当になります。FDAは、クラトムという植物は公衆の安全を脅かす可能性があり乱用の可能性もあるため、法に則りこのサプリメントの原材料からアメリカ国民の安全を守っていくとコメントしています。クラトムはMitragyna speciosa
の俗称で東南アジア諸国、特にタイ、マレーシア、インドネシア、パプアニューギニア産の薬草とされているが、クラトムは呼吸機能の降下、吐き気、減量、便秘などを引き起こし、麻薬および覚せい剤のような効果を有し、離脱症状には敵意、攻撃性、過度の流涙、筋肉や骨のギクシャクした動きや四肢運動の痛みなどを引き起こすとされています。2014年にFDAは輸入警告としてサプリメントやサプリメントの材料としてクラトムを拘留していくことを発表し、2016年1月にはレラクスプロ(RelaKzpro)の拘留を実施しました。
FDAは、製品が安全でない、または不正表示があるという理由で、食品やサプリメントの製品を拘留することができます。その後30日以内は、拘留した製品を市場に流通させないことができるので、その間に一層の強制措置、例えば差し押さえをするかどうかを判断します。
米国司法省は、クラトムは、サプリメントの材料として安全であるという合理的な保証することができる情報が不十分であるとし、イリノイ州北部地区連邦地方裁判所に訴状を提出しました。人体に重大なリスクが存在しないという十分な実証がないためクラトムを含む栄養補助食品は、FD&C法の下で安全であるとは言えないとしています。
また、FDAは消費者に対しクラトムを含む製品を摂取しないよう警告しています。ヘルスケア従事者や消費者は、FDAにクラトムを含む製品に関連する有害事象を全て報告する必要があります。
2015年12月22日
FDAがサプリメント監督のためのオフィスを新たに設立
FDAは2015年12月21日にサプリメント監督のためののオフィス、ODSP(Office of Dietary Supplement Program)の設立を発表しました。それまではサプリメントはOffice of Nutrition Labeling and Dietary
Supplements(栄養表示およびサプリメントのオフィス)の一部で管理されていましたが、サプリメント業界は過去20年間大きく成長し60億ドルから350億ドルの業界となり、コンプライアンスなど規制を更に特化していく必要があるとした背景があります。
FDAは「急速に拡大するサプリメント業界をもっと有効に規制していくために、FDA機構内のサプリメント部門の重要性を高め、政府の資源や能力を十分に活用することを目的とする。また、ODSPの設立はサプリメントへの規制の適用がより特化されるため、業界各社は一層FDAの規制に違反がないように準備周到に対応することが必要となる。必ず、FDAに登録をしラベルに医薬品紛いの不適当な効能・クレームがないように徹底することが必要となる。」とコメントしています。
2015年11月6日
栄養素強化(fortification)ポリシー
 2015年11月6日にFDAは栄養素強化(fortification)ポリシーに関するガイダンス文書を公表しました。 FDAは食品製造会社が栄養素を強化するため食品に栄養素を追加をすることができるとしています。
2015年11月6日にFDAは栄養素強化(fortification)ポリシーに関するガイダンス文書を公表しました。 FDAは食品製造会社が栄養素を強化するため食品に栄養素を追加をすることができるとしています。
FDAの栄養素強化のポリシーそのものは1980年から変化はありませんが、この新しいガイダンスは製造会社がFDAのポリシーを明確に理解することができるようにQ&A方式でわかり易く説明したものです。
栄養素強化の例として、豆乳にカルシウムを加えることは、ミルクを飲むことのできない消費者にとってカルシウムという重要な栄養素を摂取するために合理的な事と言えます。
Q. 栄養素強化のポリシーが適用される栄養素
以下の重要栄養素全てを含みます。
Vitamin A, Vitamin C, Calcium, Iron, Vitamin D, Vitamin E, Vitamin K, Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12、Biotin、Pantothenic acid、Phosphorus, Iodine, Magnesium、Zinc、Selenium、Copper、Manganese、Chromium, Molybdenum,
Chloride、Thiamin、Protein
Q. どのような食品に適用されるものか。
ヒトの消費用の全ての食品が適用対象です。サプリメント、動物用の食を目的としたものや乳幼児用のミルクには適用されません。
Q. FDAが栄養素追加するのが不適切とする食品は何か。
- 生鮮野菜や果物
- 畜肉、鶏肉、魚など
- 砂糖
- スナック(炭酸飲料を含む)
- アルコール飲料
上記のような食品に栄養素添加をすると規制措置につながります。ビタミンを追加したキャンディーなどが警告レターの対象となっている例も見られます。
Q. 栄養素強化は任意か
FDAの規格(Standard of Identity)の要求事項でなければ、通常食品への栄養素の強化は任意とされます。FDAの規格は要件としての栄養素追加、または任意の栄養素追加として米国内で販売される際には順守されるべきものです。
- シリアル用の小麦粉のエンリッチ (21 CFR 137.165);
- ベーカリー製品のエンリッチ (21 CFR 136.115);
- マカロニ用の小麦粉のエンリッチ(21 CFR 139.115);
- マーガリンのビタミンA強化は義務付け、ビタミンD強化は任意 (21 CFR 166. 110)
- ミルクのビタミンAとDの強化は任意 (21 CFR 131.110).
Q.ラベル表示はどのように行うか。
ラベル表示は、規格で定められている食品については栄養素追加されているかどうかをFDAの規定通りに明記する必要があります。
規格で定められていない食品については、"added," "enriched," "extra," "fortified," "more," and "plus"などの言葉を使用することができます。
関連記事詳細リンク
Guidance for Industry: Questions and Answers on FDA’s Fortification2015年9月16日
ヒト消費用食物のための予防的コントロールの主な要件
2015年9月16日に、米国食品医薬品局(FDA)は、食品安全近代化法(FSMA)実現の一環としてヒト消費用の食物に係る予防的コントロールについての最終規則を発表しました。
食品安全計画
当規制が適用される食品施設は、生物学的、化学的、および物理的な危険が発生する可能性を明確化し、それらのリスクが予防的コントロールを必要とするかどうかを判断し、記述した食品安全計画を作成する必要があります。また、食品施設は、これらのリスクの発生の最小化し、防止する予防的コントロールを確立する必要があります。予防的コントロールとは "プロセス、食物アレルゲン、および衛生上のコントロールだけでなく、サプライチェーンのコントロールやリコール計画も含む”とされています。
食品安全計画は予防的コントロールが一貫し有効であることをモニターし、検証する方法を含んでいる必要があります。また、食品安全計画はタイムリーで、効果的な問題対応策を含む必要があります。そして、対応策や是正措置は、記録され保持されなければなりません。
モニタリングや検証が行われるべき頻度はケースバイケースで、当該食品施設にとって適切に設定されなければなりません。
サプライヤーの管理
食品施設が食品の安全性を確保するためには、原材料や他成分を受け入れる前に、サプライヤーがどのようにリスクを予防、コントロールしているかを把握し、サプライヤーを承認し、承認されたサプライヤーのみから原材料や他成分を調達する必要があります。
食品施設は、サプライヤーを承認する際に、食品製造プロセスの危険分析を実施し、サプライヤーが危険をどのように予防、コントロールしているか評価しなければなりません。食品施設はサプライヤーのリスクの予防やコントロールについてのパフォーマンスを評価する必要があります。
従業員の資格
当規制が適用される食品施設の経営者は、製造、プロセス、包装、保存に携わる全ての従業員が必要な教育、訓練や経験を持っており、食品衛生、食品安全、健康と衛生の規則についての訓練を受けていることを確認しなければなりません。
当規制が適用される食品施設
食品施設としてFDAに登録する必要がある全ての企業は、免除対象に含まれない限り、FDAの規制の対象となります。
- 非常に小さい企業(年間総売上高 百万ドル以下)
- 水産物HACCP要件の対象企業
- 生ジュースHACCP要件の対象企業
- 「低酸性缶詰食品」要件の対象企業
コンプライアンス日付
ほとんどの食品施設は、最終規則発表の一年後までいFDA食品安全のための予防的コントロール規制に準拠する必要があります。コンプライアンス日付は以下のとおりです。
- 非常に小さい企業(年間総売上高 $1,000,000以下): 2018年9月
- 低温殺菌牛乳の条例の対象事業:2018年9月
- 中小企業(未満の500のフルタイム換算従業員と企業):2017年9月
- 他のすべての事業会社: 2016年9月
詳細リンク:
http://www.fda.gov/Food/GuidanceRegulation/FSMA/default.htm
2015年7月24日
 ラベル改定案への補足規制案
ラベル改定案への補足規制案
FDAは2014年2月に発表したラベル改定案の補足的規則案として、以下2点の変更点を発表。ラベルの改定についての最終決定予定は 2016年の3月が見込まれる。
- 原案では添加糖分の表示については、一日摂取量の何パーセントに当たるかを栄養分析表に記載する必要はなかったが今回の変更案により記載が必要となる。一日摂取量の添加糖分は一日総摂取カロリーの10%以下にするというガイドラインに基づくもの。
- 栄養分析表の説明が消費者にとって更に解かり易いように現行の文章からの変更案。
現行:
“Percent Daily Values are based on a 2,000 calorie diet. Your Daily Value may be higher or lower depending on your calorie needs”
変更案:
“Percent Daily Value (%DV) tells you how much a nutrient in a serving of food contributes to a daily diet. 2,000 calories a day is used for general nutrition advice.”
2015年7月6日
レストランチェーンと自動販売機のラベルの義務化-準拠期日の延長
FDAは2014年12月1日にレストランや自動販売機で販売する食品についてもカロリー等の栄養情報を明確にすることを義務付けるルールを発表したが、同規制の準拠期日を当初案の2015年12月1日から一年延長し2016年12月1日にすることを発表。レストラン業界など業界団体からソフトウェアの開発や従業員のトレーニングに時間が掛かっている問題が主張され、またFDA側からの正式なガイダンスもまだ公表されていないことなどが理由とみられる。
2015年6月16日
FDAは部分水素添加油の原則禁止に3年の猶予
FDAは、トランス脂肪酸の主要な起源とされる部分水素添加油(PHO)について、GRAS(一般的に安全と認識される物質)とは言えないとして、2018年6月以降、食品に加えることを原則禁止すると発表した。主に大豆油などの液状油に対して部分水素添加を行うことによってマーガリンのような固形油としたり、酸化安定性の高い液状油としたりすることが出来る一方で、心臓疾患のリスクを高めるとされるトランス脂肪酸の発生源となるため2013年11月の仮決定から可否について活発に議論された。
 PHOは、マーガリン以外にも、デザートや電子レンジ用ポップコーン、冷凍ピザ、コーヒークリーマ―などその有用性ゆえに多くの食品製造会社により100年以上製造、使用されてきておりGRASリストにも長年に亘り含まれてきた。近年はトランス脂肪酸について安全性が問題視されてきており、2006年にはFDAが食品の含有量表示にトランス脂肪酸の量を記載するよう義務付けられ、2013年にPHOの規制案が公表されていた。この流れを受けて大手食品メーカーは自主的に代替原材料の開発など段階的にPHOの使用を減らしてきている。米国では一人当たりのトランス脂肪酸の消費量は2003年の4.6グラムから2012年は1.0グラム程度と大幅に減少しているが、この動きを更に徹底するのが狙い。FDAではトランス脂肪酸消費量の一層の減少により年間20,000人の心臓発作の減少、そして予防可能な心臓病による死亡者を年間7,000人減らすことができるとしている。
PHOは、マーガリン以外にも、デザートや電子レンジ用ポップコーン、冷凍ピザ、コーヒークリーマ―などその有用性ゆえに多くの食品製造会社により100年以上製造、使用されてきておりGRASリストにも長年に亘り含まれてきた。近年はトランス脂肪酸について安全性が問題視されてきており、2006年にはFDAが食品の含有量表示にトランス脂肪酸の量を記載するよう義務付けられ、2013年にPHOの規制案が公表されていた。この流れを受けて大手食品メーカーは自主的に代替原材料の開発など段階的にPHOの使用を減らしてきている。米国では一人当たりのトランス脂肪酸の消費量は2003年の4.6グラムから2012年は1.0グラム程度と大幅に減少しているが、この動きを更に徹底するのが狙い。FDAではトランス脂肪酸消費量の一層の減少により年間20,000人の心臓発作の減少、そして予防可能な心臓病による死亡者を年間7,000人減らすことができるとしている。
2015年3月20日
遺伝子組み換え(GMO)食品
FDAはオカナガンのスペシアリティフルーツ社の遺伝子組み換えをしているリンゴ2種類とJRシンプロット社の遺伝子組み換えをしている6種類のジャガイモについての評価結果を発表しました。オカナガンのリンゴは切り口などの褐変の原因となる酵素レベルを低下させたもの、またJRシンプロットは黒色のスポットの発生原因の酵素を減少させ更にアクリルアミド(ネズミの試験で発ガン性があるという結果がでている物質)を減少させたジャガイモを生成。
2015年3月20日に、FDAはこれらの食品は、従来の品種と安全性と栄養面で同等であると結論付けました。
 遺伝子工学とはバイオテクノロジーとも呼ばれ、科学者によって食物の形質や特性を変更するために使用される方法を指します。
遺伝子工学とはバイオテクノロジーとも呼ばれ、科学者によって食物の形質や特性を変更するために使用される方法を指します。
FDAによると1990年代から遺伝子組換えをした植物はフードサプライに入っており、適用される安全基準は従来の食品のものと同様です。
FDAは遺伝子組み換え食品の安全性を確認するために、任意でバイオテクノロジー協議プロセスを提供しています。同協議のプロセスは、従来の品種との比較上、分子の変化や栄養組成物の性質についての情報を会社がFDAに提出しレビューしてもらうものです。
FDAはこれまでの約166のバイオテクノロジー協議を完了し、遺伝子組み換え食品は、従来の食品との比較上一般的に栄養価は同様であり、アレルギー性又は毒性反応についてのリスクは大きくないということがわかっています。具体的な例は以下のリンクをご参照のこと。
http://goo.gl/QJ3vbq
現在、FDAでは食品製造業者に対し遺伝子組み換えの原材料を使用しているか否か製品ラベルに記載することを義務付けていませんが、消費者団体からの嘆願書により遺伝子組み換え食品に対する表示義務を検討中です。現状は自主的にラベルにその情報を含むことは可能です。
2001年に、FDAは遺伝子組み換えされた食品の製造業者のための任意のラベリングガイダンスを公表しました。ここには用語の定義とともに、遺伝子組み換えをしている食品を含む場合と含まない場合について、それぞれの適切な表現について詳しく説明があります。
http://www.fda.gov/Food/GuidanceRegulation/GuidanceDocumentsRegulatoryInformation/ucm059098.htm
当ガイダンスでは遺伝子組み換えされた食品が、従来の品種のものと著しく異なる場合は新しい食物として名前を変更する必要がある。また、食品が従来の品種と著しく異なる栄養特性を持っている場合はラベルで違いを明確化するべき、更に消費者が食品の名称からは期待できないアレルゲンが含まれている場合は、そのアレルゲンの存在をラベルにて開示するなどがポイントとなっています。
消費者は遺伝子組み換え、または遺伝子工学という言葉より、バイオテクノロジーという言葉を好んでいるとみられ、また遺伝子組み換えの目的(栄養価を高めるためか、耐変色性か)に興味を持っているようです。そのため、遺伝子組み換えされた食品を識別するための言葉は例えば次のようになります。「この製品は、害虫に対する抵抗性を高めるためにバイオテクノロジーを用いて開発されたトウモロコシを原材料として使用しています。」
またFDAは、食品中に栄養価値の面で改善された遺伝子組み換えの原材料が少量だけ含まれている場合には、食品全体の栄養価値が改善されているような記述をすることは誤解を招く可能性がある、として警告しています。
2015年3月17日
カインド社向け警告書発行
FDAは、カインド社に対し以下製品のラベルやウェブサイトでの宣伝文言が食品ラベルの規制に違反しているという内容の警告書を発行し、是正処置を15日以内にFDA向けに提出するように通知しました。
警告書によると、ラベルには「健康で美味しく、便利で健康的」と記載されているが以下の製品のいずれもFDAの定める「健康的」の基準を満たしていないことをはじめ様々な問題点を指摘しています。
1) KINDフルーツ & ナッツアーモンド & アプリコット
2) KINDフルーツ & ナッツアーモンド & ココナッツ
3) KINDプラスピーナッツバターダークチョコレート + タンパク質
4) KINDプラスダークチョコレートチェリーカシュー + 抗酸化物質
製品のラベル表示に「健康的」や関連する文言を使用するためには、通常消費リファレンス量(RACC)当たりの飽和脂肪含有量が1グラム以下、そして飽和脂肪からのカロリーが全体の15%以下であることが要件となっています。上記の製品は、飽和脂肪の含有量が2.5グラムから5グラムであり、更にRACC 40グラム当たりの飽和脂肪含有量は上記の2要件の両方とも超えているとしています。
参照製品名の3)と4)の「+」(プラス)の表示について、FDAによると1日当たりの推奨摂取量の少なくとも10パーセント以上含まれていることが必要であるが満たされていないと指摘しいます。
また、「抗酸化物質に富んだ」と記載するには、抗酸化活性を有する特定の栄養素がのFDAのリファレンス一日摂取量(RDI)の少なくとも20%含まれている必要があるが、カインドの製品は、ビタミンEのはRDIの15%しか含まれていないとしています。
同警告書では他のラベル上の問題を細かく指摘していますが、警告書のリンクは以下の通りです。
http://www.fda.gov/ICECI/EnforcementActions/WarningLetters/ucm440942.htm
2015年3月10日
ダンキンドーナツ 粉砂糖レシピから二酸化チタンを除去することを発表
ドーナツ会社ダンキンドーナツは今後パウダーシュガーのレシピに増白剤の二酸化チタンを使用しないことを発表しました。これは2013年に環境保護団体により行われたラボテストの結果、ダンキンドーナツのパウダーシュガーに二酸化チタンのナノ粒子が発見されたと言われたことを受けたものです。2014年に同社は代替レシピを開発し2015年3月に今後はパウダーシュガーのレシピに二酸化チタンを使用しないと公表するに至ったものです。
 環境保護団体によるとナノ粒子は、細胞、組織および器官に入り身体に損傷を引き起こす可能性が高いとしています。一方、二酸化チタンは日焼け止めをはじめ化粧品に一般的、且つ広範に使用されていますが、カリフォルニア州安全化粧品制度では癌を引き起こす可能性のある物質として原材料として使用する場合には届出を義務付けています。
環境保護団体によるとナノ粒子は、細胞、組織および器官に入り身体に損傷を引き起こす可能性が高いとしています。一方、二酸化チタンは日焼け止めをはじめ化粧品に一般的、且つ広範に使用されていますが、カリフォルニア州安全化粧品制度では癌を引き起こす可能性のある物質として原材料として使用する場合には届出を義務付けています。
FDAによる規制では、食品に二酸化チタンを使用することに対しては構成比が全体の1%以下であることを定めていますが以下の制限を準拠していれば使用禁止ではありません。
http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfCFR/CFRSearch.cfm?fr=73.575
2014年12月9日
食品ラベル変更の一律コンプライアンス適用日程
FDAは2015年と2016年に発表される食品ラベル変更についての一律コンプライアンス適用日を2018年の1月1日と発表。2014年2月27日発表のFDA栄養分析ラベルの変更案を始めとしてラベル表示の変更が予想されるが、食品会社への経済的影響を考慮し新規制への移行に十分に時間をとる動き。
2014年12月1日
レストランチェーンと自動販売機のラベルの義務化
 FDAは、レストランと自動販売機で購入する食品についてもカロリー等の栄養情報が消費者に明確にわかるようにすることを義務付ける最終ルールを発表。2010年医療保険制度改革の一環として、消費者に摂取する食品の栄養情報を認識させることを目的にしている。FDAはアメリカではカロリーの約1/3が家の外で摂取されているとしており、また肥満と分類されるアメリカ人は、外食の際に家での食事に比べ一食当たり100カロリー以上余分に消費しているとしている。
FDAは、レストランと自動販売機で購入する食品についてもカロリー等の栄養情報が消費者に明確にわかるようにすることを義務付ける最終ルールを発表。2010年医療保険制度改革の一環として、消費者に摂取する食品の栄養情報を認識させることを目的にしている。FDAはアメリカではカロリーの約1/3が家の外で摂取されているとしており、また肥満と分類されるアメリカ人は、外食の際に家での食事に比べ一食当たり100カロリー以上余分に消費しているとしている。
最終規制が適用されるレストランチェーン*の対象は以下の通り。
1. 20以上のロケーションにて展開
2. 同じ名前で運営
3. 実質的に同じメニューアイテム
*レストランとはカフェ、ベーカリー、コーヒーショップ、デリカテッセン、アイスクリームショップ、お持ち帰り用サンドイッチの店、コンビニ、映画館、ボーリング場、遊園地なども含む。
メニューやメニューボードにメニュー名称と価格に隣接してカロリーを明確に表示することが義務づけられることになる。セットメニューやアルコール、セルフサービスのものについても同様の扱い。例外扱いとなるものは、一時的なメニュー、その日のスペシャル、ケチャップやマヨネーズ等の調味料。表示の際に、“一日当たり2,000カロリーを基準としていますが必要カロリーは個人によって異なります。”と表示し、メニュー毎にカロリー以外の以下の栄養素につき記載したものも準備し消費者からリクエストがあった際に提示できるよう準備する事が義務付けられている。また、これらの情報がリクエストによって閲覧できることをメニューやメニューボードに書いておくことも必要。
- カロリーと脂肪からのカロリー
- 総脂肪、飽和脂肪、およびトランス脂肪
- コレステロール
- 塩分
- 総炭水化物
- 食物繊維
- 糖分
- タンパク質
同規制の準拠期日は2015年12月1日。
 一方、自動販売機については20以上の自動販売機を運営している場合、一食当たりのカロリーを製品に隣接している場所(自販機の内部)や選択ボタン(自販機の内部)、または製品そのものに記載することが義務付。どちらの記載方法でも表示は購入前に明確に見えるため字のサイズや色遣いに注意することが必要。
一方、自動販売機については20以上の自動販売機を運営している場合、一食当たりのカロリーを製品に隣接している場所(自販機の内部)や選択ボタン(自販機の内部)、または製品そのものに記載することが義務付。どちらの記載方法でも表示は購入前に明確に見えるため字のサイズや色遣いに注意することが必要。 同規制の準拠期日は2016年の12月1日。
2014年10月15日
Partially Hydrogenated Oil (PHO=部分的水素添加油脂)の使用禁止案
2013年11月7日にFDAは、食品へのトランス脂肪の使用を禁止する方向で動いているという事を発表しました。本件に関するパブリックコメントの締め切りは2014年1月7日でしたが、業界団体などから十分なテスト結果を出すために時間が必要であるとし、3月8日までに締め切りが延長となりました。
(過去の関連記事はこちら)
2014年10月15日時点、本件に関するFDAからの追加発表等は行なわれていませんが、パブリックコメントを参照すると食品業界からの立場と医療業界からの立場に大きく分かれ、医療業界は健康上の問題としてGRAS(一般的に安全と認識される物質のリスト)から外す案に同意、一方食品業界はPHOの全面禁止ではなく使用分量の削減等の代替案を挙げています。大手食品会社のネッスル、コンアグラ、ジェネラルミルズ等は一食分当たりのトランス脂肪の量を0.2g以下にする、そして現在一食分あたりトランス脂肪の量を現在0.5g以下の場合0gと記載する規則を0.2g以下にすることによりトランス脂肪の摂取量を減らすという代替案を出しています。そしてPHO
の使用は製造上必要な最小限の微量であれば、食品着色料、フレーバー、スパイス、加工助剤と同様使用可、とする案を出しています。
食料品製造協会(Grocery Manufacturing Association)は加工上、PHOが必要で最終製品に残存する量は微量であり、全面使用禁止よりラベルに関する規則を変えるほうが結果的にトランス脂肪の摂取量を減らすのにもっと現実的で効果的としています。
全国菓子業界(National Confectioners Association)はケーキ、アイスクリーム、トッピング、マーガリン、コーヒークリーマー、ガムなど様々なものに少しずつ入っており、製造原材料や加工助剤に必ずと言ってよいほど入っている。全ての原材料につきPHO使用を全面禁止というのは製造方法上の悪夢、業務や製造の継続ができない。また米国以外でPHOの全面禁止の国はないため、輸入食品や原材料のリコールなどが起こり製造業務の中断を意味する、としています。
一方スナック食品協会ではトランス脂肪が少ない新PHOが開発されえおりそれであればトランス脂肪が少ないので代替材料として使用可なのではないか、との意見を出しています。
このように業界側は製造上最低必要量の使用を許容しPHOの使用全面禁止については反対しており引き続きFDAからの発表をモニターしていく必要があります。
2014年10月2日
FDAインスペクションの結果公表
FDAは施設向けインスペクションの結果と執行について分かり易い形での一般公開を始めました。Data Dashboardと呼ばれるもので2009年から2013年にかけてのデータが閲覧可であり今後年二回にアップデートされていきます。以前もある程度は同様の結果を見ることはできましたが本システムではグラフで分かり易くまとめられています。
http://govdashboard.fda.gov/
Food Safety and Applied Nutrition (食品安全応用栄養=CFSAN)、Center of Drug Evaluation and Research (医薬品評価研究センター=CDER)等、FDAの6センターが行ったインスペクションの結果を以下の3つのカテゴリーに分別しています。
- Official Action Indicated (OAI) -重要な問題点の発覚、是正措置要。
- Voluntary Action Indicated (VAI) - 問題点はあるものの重大ではない。
- No Action Indicated (NAI) - 特に是正措置を要する問題無し。
2011年からFDAは食品安全近代化法 (FSMA=Food Safety Modernization Act) 推進の一環として食品製造関連施設のインスペクションを強化させているのはご周知の通りですが。米国内の施設についてはハイリスクの施設は3年毎、ハイリスクでないところについても5年に一回はインスぺクトすることが義務付けられています。 海外の施設に対しても益々インスペクションを増強し安全性に関する事故・問題が起こる前に対処することが求められています。
FDAのインスペクションは初回は無料ですが安全性に係わる重大な問題が発覚し再インスペクションを要する場合については有料となります。FDA側でスペクションの準備、実際に再インスペクションを行う時間、移動にかかる時間などが含まれ 費用が嵩みますので(米国内で時間当たり $217、国外では$305)再インスペクションや業務の中断を避けるためにも十分な準備が必要です。
2014年8月5日
グルテン-フリー("gluten-free")ラベル表示の定義
2014年8月5日付で一年前に公表された通りに"gluten-free" と記載する場合グルテンの含有量は20ppm (parts per million) 以下であることが正式に義務付けられました。2013年8月にFDAは"グルテンフリー"とラベルに記載できる定義の最終版の詳細を公表しましたが、連邦レベルで決定、公表されてから一年後 同定義が義務付けられ遵守できていない場合は規制上の措置が取られます。ケーキ、パン、シリアル、パスタなどに含まれるグルテンの摂取はセリアック病を持つ消費者にとって生命にかかわる重大な事項であるため、この規則はパッケージで小売店で販売される食品は勿論、レストランなどでも"gluten-free"と記載する際にも同様に適用されます。
2014年7月
濃縮カフェインパウダー
ネット上などで濃縮カフェインパウダー(100%カフェイン)を購入し摂取したティーンエージャーが死亡した事件があったことを受け、FDA では消費者に濃縮カフェインパウダーを摂取しないことを呼び掛けています。一般家庭で使用される計量スプーンなどで測って取得すると大変危険な量を摂取することになり深刻な健康上の問題となる可能性があります。小さじ一杯に含まれるカフェインの量がほぼコーヒー25杯分に含まれるカフェインの量と同等でありカフェイン中毒の症状として、心臓の急速または不安定な動悸を促し、嘔吐、下痢、昏迷、発作や死に至ることもあります。カフェインを摂取する消費者はこのような潜在的なリスクの深刻さを知り、また保護者は若年層がこのような刺激物に興味を持つことを認識し十分に注意することを呼び掛けています。
2014年2月27日
FDA栄養分析ラベルの変更案発表
食生活と慢性疾病に関連性があることは様々な研究により明確であり、依然として減る傾向のみられない肥満や心臓病を減らすことを目的にFDAは栄養分析ラベルに変更を加える方向であることを発表しました。
FDAラベル表示の変更の意図は、消費者が食生活をする上で、添加砂糖、油脂の種類、塩分摂取量、そして摂取カロリーについて注意を払い肥満や心臓病の原因を減少させることです。変更の中心となるポイントはカロリーや一食分の量で、文字サイズを大きくし太字にすること、その他添加糖分の記載も新たに義務付けらることなります。米国人の食生活では平均16%のカロリーが添加糖分によるものと推定されています。
ラベルを参考に血圧に懸念のある消費者はSodiumとPotassiumの摂取量を、骨の健康に懸念のある消費者はカルシウムとビタミンDを、心臓病にはSodiumと脂肪の含有量を特に気をつけて消費量を調節する判断材料となります。今回のラベル変更案の要点は以下の通りです。
- 一食分のカロリーの数字をもっと大きく見易くする。
- 一食分の量をもっと現実に近いものに変更(一食分としてどれだけの量を食べるべき、ではなくもっと現実的にどれだけ食べるのかをベースにする。)
- 一日分摂取量のパーセンテージを右側ではなく、左側に記入する。
- 添加糖分を別表示
- 脂肪の種類を明記
- Vitamin D(健全な骨目的)とPotassium(高血圧予防目的)を新たに表示項目として加える。
発表後90日間でパブリックコメントを集め、その後実際にどのように変化するか決まるのが一年後、その後、実際の変更には更に2年ぐらいの期間がかかるものと推測されます。
2014年1月3日
Partially Hydrogenated Oil (PHO=部分的水素添加油脂)の使用禁止案
当初、本件に関するパブリックコメントの締め切りは2014年1月7日でしたが、業界団体などから十分なテスト結果を出すために時間が必要であるとし、3月8日までに締め切りが延長となりました。
2013年11月7日にFDAは、食品へのトランス脂肪の使用を禁止する方向で動いているという事を発表しました。Partially hydrogenated oils
(PHOs)はトランス脂肪を含んでおり、クラッカー、クッキー、スナック菓子、冷凍ピザ、野菜ショートニングなど米国で加工食品に広く一般的な原材料として使用されています。食品の賞味期限と風味の安定を目的に1950年代から一般的に使用されていますが、長年に亘る研究の結果、トランス脂肪はLDLコレステロールを増加させ動脈の内側にプラークを蓄積させ、心臓発作を引き起こす可能性のある環状動脈心臓病に直接関連性が高いことがわかってきました。
上記の公衆衛生上の懸念に対応するため、トランス脂肪の使用量を減少させることを目的に1999年FDAはラベルの栄養成分表にトランス脂肪の量を記載するように提案、2006年には義務付けましたが、現在でもトランス脂肪が含まれている食品が大量に出回っているのが実情です。CDC(Center of Disease
Control=疾病管理予防センター)では米国の食品供給におけるトランス脂肪の一層の減少は毎年心臓病による死亡数7,000人、心臓発作の数を20,000減少することが可能と推定しています。FDAは予備決定としてPHOをGRAS(Generally Recognized As
Safe=一般的に安全と認識されている)物質のリストから外すという内容の通知を連邦官報で行ないました。この予備決定が確定した場合は、PHOを米国で合法的に販売するためにはFDAの市販前承認が必要となってきます。市販前承認では各製造会社がPHO、またはPHOを含む食品が安全であると証明しなければいけないというハードルがでてきます。
一方現実問題として長年に亘りGRAS食品成分として広く使用されてきている背景上、FDAがPHOをGRASでないと決定した場合は徐々に米国の食品供給におけるPHOの使用を廃止していくための方法を確立していく必要があります。本件について、締め切りを2014年1月7日に、FDAは業界や専門家、その他一般にパブリックコメントを求めていました。2014年4月30日時点では本件に関するFDAからの追加発表等は行なわれていません。
2013年8月2日
グルテン-フリー("gluten-free")ラベル表示について
FDAは"グルテンフリー"とラベルに記載できる定義の最終版を公表しました。
ケーキ、パン、シリアル、パスタなどに含まれるグルテンの摂取はセリアック病**を持つ消費者にとって生命にかかわる重大な事です。そのためグルテンの表示はセリアック病を持つ消費者にとって非常に重要な情報であるにもかかわらず、これまでグルテンについてのラベル表示は連邦レベルでの基準や定義がなく、一般的に"gluten-free"の表示 は "without gluten" "free of gluten"
"no gluten" と全く同等とみなされてきました。
今回連邦レベルで決まった"gluten-free" の定義は、グルテンの含有量を20ppm (parts per million) 以下であることとしています。セリアック病を持つ消費者にとってこの水準以下の量であれば重大な影響をもたらさないとされる分量、そして国際的基準や他国の基準値とも同等のレベルです。現在“グルテンフリー“とラベルのついている食品の推定5%はグルテンが20ppm以上が含まれていると推測されています。
FDAは20 ppm以下のグルテンを許容すると共に、以下の食物については"gluten-free"とラベルに記載することを許可しています。本質的にグルテンの入っていないもの、例えば果物、野菜、卵や水など。本規制は8月5日付けで施行されますが、食品会社は一年以内に対応することが義務付けられます。多くの食品は既にこの規制を遵守しているものと推測されていますが一年後に遵守されていない場合は不正表示として規制措置の対象となります。
*グルテンとは
小麦、ライ麦、大麦、これら穀物の雑種で自然に発生するタンパク質を意味する。
**セリアック病
米国では300万人もの人がセリアック病を持っていると言われていますが身体の自然な防御システムがグルテンに反応するとき、小腸の粘膜が攻撃されることによって起こるものです。健康な腸のライニングがなければ、体は必要な栄養素を吸収することはできません。そのため成長の遅延、栄養不足、貧血、骨粗しょう症などの疾患につながる可能性があります。
2013年7月26日
食品輸入に対する規制強化
FDAは食品安全近代化法 (FSMA=Food Safety Modernization Act) 推進の一環として、輸入食品の安全性の一層の強化のためのプロポーザルを公表しました。外国で製造された食品が米国に輸入される際、認定機関により安全性の検査が必要になるというもので、原案はフローチャートも複雑で時間面にも費用面でも、中小企業によっては大きな負担となってくると予想される内容です。
 現在、FDAは関連業界、企業や専門家からのヒアリング中で最終規制は2015年6月30日頃決定の見込みです。これは、外国サプライヤー認定プログラム(FSVP=Foreign Supplier Verification
Program)と暫定的に呼ばれるもので、食品輸入の際に認定機関による検査が行なわれうようになるというものです。食品といってもカテゴリーも品数も非常な数のため全ての製品に対して認定機関による検査を行われるのは現実的ではなく、輸入業者が各食品の製造過程で、危険重要管理点(HACCP=Hazard Analysis Critical Control
Point)いわゆる現在魚類や生ジュースの製造に対してて義務づけられている分析作業や社内記録を基準判断として用い、必要と判断される製品に対してのみ認定機関による検査を行うものと考慮されます。
現在、FDAは関連業界、企業や専門家からのヒアリング中で最終規制は2015年6月30日頃決定の見込みです。これは、外国サプライヤー認定プログラム(FSVP=Foreign Supplier Verification
Program)と暫定的に呼ばれるもので、食品輸入の際に認定機関による検査が行なわれうようになるというものです。食品といってもカテゴリーも品数も非常な数のため全ての製品に対して認定機関による検査を行われるのは現実的ではなく、輸入業者が各食品の製造過程で、危険重要管理点(HACCP=Hazard Analysis Critical Control
Point)いわゆる現在魚類や生ジュースの製造に対してて義務づけられている分析作業や社内記録を基準判断として用い、必要と判断される製品に対してのみ認定機関による検査を行うものと考慮されます。
輸入業者は、1) 外国食品会社やその製品がFDAのコンプライアンス関係で現状問題がないか、2) 危険が発生しうる可能性や問題が発生した場合の深刻度を勘案した上で、認定機関による検査を実施、その結果を社内記録として保管することになります。
また、FDAが米国と安全基準が同等とする国の企業で、当企業もFDAのコンプライアンス関係で良好なステータスを保持している場合、または、売り上げが50万ドル以下の零細企業、サプリメント企業向けには当規則が緩和されて適用される可能性があります。
既にHACCPの対象となっている企業、個人的消費を目的としている食品、アルコール類、再輸出目的のもの、リサーチや評価目的の食品などは除外されます。
最終ルールが決まり公表されてから60日後に規則が有効となり、それから18ヶ月の猶予期間が見込まれます。FDAもこのプログラム導入には時間もコストもかかることを理解しており準備期間を十分に設けている他 既にHACCP等の対象となっている会社には2重の規則のコンプライアンスの負担にならないよう配慮があるとされています。
原文詳細は以下のウェブサイトをご参照
http://www.gpo.gov/fdsys/pkg/FR-2013-07-29/pdf/2013-17993.pdf
2013年4月8日
遺伝子工学により開発された原材料使用の際のラベル表示義務付けについて
FDAは遺伝子工学により開発された原材料使用のラベル表示義務付けについて市民請願を受け現在協議検討中。今までも遺伝子組み換え植物の原材料使用の場合、ラベル記載を義務付けるべきという内容の問い合わせを数多く受けています。
FDAは消費者が食品が遺伝子工学を用いて開発された原材料が使用されているかどうかに強い関心を抱いていることを十分認識しており、現状、遺伝子工学由来の食品であるか否かを自主的に表示することについて支持しています。実際食品メーカーの中では、遺伝子工学により開発されたものかどうかを任意表示している例もあります。
 FDAの役割は、適切なラベル記載の安全な食品が流通され、その他規制も遵守していることを確認することであり、食品が遺伝子組換えの植物であるないに関わらず、同様の要件を満たす必要があるというのがFDAの基本的スタンス。
FDAの役割は、適切なラベル記載の安全な食品が流通され、その他規制も遵守していることを確認することであり、食品が遺伝子組換えの植物であるないに関わらず、同様の要件を満たす必要があるというのがFDAの基本的スタンス。
適切なラベル表示は食品業界にとって重要事項の一つであり、この点についてもFDAの今後の動きを注意する必要があります。
遺伝子組み換え植物の大半はトウモロコシ油、カノーラ油、ダイズ、ワタ、主に他の食品に使用される成分を製造するために使用される。スープ、ソース、コーンスターチ、汎用甘味料としてのコーンシロップ、及び綿実油、マヨネーズ、サラダドレッシング、シリアル、パン、スナック食品中の大豆油等。
2013年3月
ビスフェノールA(BPA)について
ビスフェノールA(BPA)は1960年代から多くの硬質プラスチックボトルや金属系の食品と飲料缶に広く使用されてきている化学物質。
FDAの現在のスタンスは、BPAは非常に低レベルであれば安全、この評価は、今まで行われてきた研究や多くの科学者のコメントに基づくものです。確かに標準的な毒性試験の結果は現状の"低レベルであればBPAは安全である"ということを十分裏付けているといえます。しかし、新たなアプローチによる微妙な影響度をテストするため、国立衛生研究所(National Institutes of
Health=NIH)の国家毒性プログラムとFDAによる最近の研究の結果は、胎児、乳幼児、および幼児の、脳、行動、前立腺へのBPAの潜在的な影響にある程度の懸念があるというものです。このためBPAの毒性研究のためFDAのナショナルセンターは、国家毒性プログラムと協働で、BPAの潜在的リスクを更に明確にするための詳細な研究を行っています。消費者団体はBPAのリスクから消費者を守るため、食品供給の上で、FDAがBPA使用に対する規制を行うよう働きかけており、食品・包装業界にとっては、特に今後の動きが注目されます。
暫定的にFDAは食糧供給過程でのBPAのエクスポージャーを低減するために以下のような合理的な措置を取っています。
- 米国販売用のBPA含有の哺乳瓶や乳児用カップの生産停止する業界の行動を支援
- 粉ミルク缶のライニングのためのBPAの代替品の開発の促進
- 他の食品については、缶のライニングにBPA代替品の使用や、BPAレベルを最小限に抑えるための努力を支援
- BPAの規制の枠組み作成への移行支援
- BPAを取り巻く科学に関する積極的なパブリックコメントや外部からの情報収集
- 乳児用粉ミルクや食事の準備に関するBPAのエクスポージャーを減らすための保健社会福祉省(Department of Health and Human Services)からの勧告の支持
2013年1月
2012年の食品安全近代化法(FSMA)の導入について
2011年1月に、米国食品医薬品局(FDA)が食品安全近代化法(FSMA)の導入により食品の安全性への取り組みを大幅に改定することが決議されました。2012年もFDAは引き続きFSMAの導入を実施しました。これは過去70年の米国の食品の安全上最も大幅且つ重要な改定です。 焦点は"事故や問題があった場合の対処"から"予防策"へのスタンスの変化というポイントです。FSMAは、食品の製造業者、梱包者やエージェントの役割や規定、新しい要件について幅広く解説しています。2012年に導入された重要な変更のいくつかは以下の通りです。
海外の食品設備検査の充実
米国への食品輸入は毎年大幅増加傾向にあり、食中毒など問題も増え続ける傾向にあります。FDAは2011年度に、約1,000に上る外国の食品施設を検査しましたが、FSMAにより今後海外の食品施設の検査を大幅に強化する方向性を明確化しました。食品施設登録のメールアドレス
FDAは、食品・飲料業界とのコミュニケーションを強化する一環として、食品施設の登録に連絡先の電子メールアドレスの記載を義務付けました。電子メールアドレスがFDAのリストに含まれていない企業はFDAからの重要な通信を受けられないことになりますので注意が必要です。また、食品施設登録は隔年に登録更新することが義務付けられました。FDAによる社内資料のアクセス
人体や動物の健康へ重篤な有害影響を与える可能性がありうる場合、FSMAによりFDAの社内資料へのアクセスが許可されることになりました。FDAによる各国との安全性のための協力
FDAは食品安全性のため中国と緊密に協力することに合意、またニュージーランドの食品安全システムが米国に匹敵すると認識しました。ニュージーランドは米国と匹敵する食品安全システムを有する国として認識された第一号となりました。この諸外国との食品安全性の比較評価システムはInternational Comparability Assessment Tool (ICAT)と呼ばれるもので、食品安全に関する関係法令や検査等を含む包括的なシステムです。